题目内容
【题目】在研究酸碱中和反应时,某小组同学想证明:盐酸与氢氧化钠溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。
①方案一:测定盐酸与氢氧化钠溶液混合前后的pH。
测定该盐酸的pH,pH (16) 7 (选填“大于”、“等于”或“小于”)。将一定量的氢氧化钠溶液加入该盐酸中,混合后测定其pH大于7 ,此时该溶液中溶质是 (17) 。
结论:HCl与NaOH发生了中和反应。
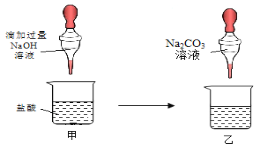
②方案二:如图所示,乙烧杯中观察到 (18) 。
结论:HCl与NaOH发生了中和反应。
写出烧杯甲中反应的化学方程式: (19) 。
【答案】①小于 氢氧化钠、氯化钠或NaOH、NaCl
②烧杯乙中没有气泡产生 NaOH+HCl==NaCl+H2O
【解析】
试题分析:①盐酸显酸性,故测定该盐酸的pH,pH小于7,将一定量的氢氧化钠溶液加入该盐酸中,混合后测定其pH大于7 ,说明NaOH过量,故此时该溶液中溶质是:除了生成的氯化钠,还有过量的氢氧化钠
②右图所示,是将Na2CO3溶液滴加到反应后的溶液中,故乙烧杯中观察到:烧杯乙中没有气泡产生,则证明没有盐酸,HCl与NaOH发生了中和反应;烧杯甲中反应的化学方程式:NaOH+HCl==NaCl+H2O

练习册系列答案
相关题目