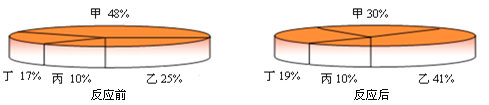
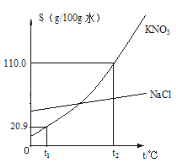
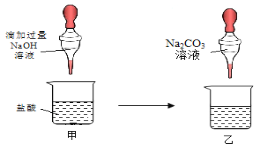
题目内容
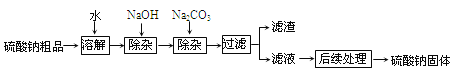
【题目】请结合下列实验装置图回答有关问题。

①仪器:a用途 (22) ,b名称 (23) 。
②用氯酸钾与二氧化锰混合制取并收集一瓶较纯净的氧气,可选择的装置组合: (24) (填字母),反应的化学方程式为 (25) 。
③实验室制取二氧化碳气体,装置A、B都可用作发生装置,其中可以控制反应进行的是 (26) (填装置序号),反应的化学方程式是 (27) 。
④同学们分析认为③中剩余溶液中一定有氯化钙,可能有盐酸。为验证是否含有盐酸,他们采用不同方案进行实验,得出相同的结论。
实验操作 | 实验现象 | 结论 | |
方案一 | 取样,加一枚生锈的铁钉 | (28) | 有盐酸 |
方案二 | 取样,滴加AgNO3溶液和稀硝酸 | 产生白色沉淀 |
上述实验方案中,合理的是 (29) (选填:“方案一”或“方案二”);另外一个实验方案不合理的原因:
(30) 。
“方案一”中反应的化学方程式为 (31) 。
【答案】①添加液体 锥形瓶 ②C E 2KClO3![]() 2KCl + 3O2 ↑
2KCl + 3O2 ↑
③A CaCO3+2HCl→CaCl2+CO2↑+H2O ④ 铁锈溶解,溶液呈棕黄色
“方案一” 氯化钙也能与硝酸银反应产生难溶于稀硝酸的白色沉淀
Fe2O3+6HCl==2FeCl3+3H2O
【解析】
试题分析:①仪器a是长颈漏斗,用途:添加液体;b名称:锥形瓶
②气体发生装置的选择依据:反应物的状态和反应条件,用氯酸钾与二氧化锰混合制氧气,是属于固固加热型,故选发生装置C,收集一瓶较纯净的氧气,宜选择排水法,故选E;反应的化学方程式为:2KClO3![]() 2KCl + 3O2 ↑
2KCl + 3O2 ↑
③实验室制取二氧化碳气体,装置A、B都可用作发生装置,其中可以控制反应进行的A ,因为可以通过控制弹簧夹来达到固液分离;反应的化学方程式是:CaCO3+2HCl→CaCl2+CO2↑+H2O
④ 根据酸的化学性质,能与金属氧化物反应,故加一枚生锈的铁钉,发生反应:Fe2O3+6HCl==2FeCl3+3H2O,现象为:铁锈溶解,溶液呈棕黄色 ;上述实验方案中,合理的是“方案一”; 另外一个实验方案不合理的原因:氯化钙也能与硝酸银反应产生难溶于稀硝酸的白色沉淀;
“方案一”中反应的化学方程式为:Fe2O3+6HCl==2FeCl3+3H2O

【题目】(5分)结合教材中关于二氧化碳收集方法的描述:二氧化碳能溶于水,一般不用排水法收集。某化学小组分成两组进行实验,研究是否能用排水法收集二氧化碳的问题。
[查阅资料]二氧化碳不溶于饱和碳酸氢钠溶液。
[知识储备]写出下列化学方程式:
①实验室制备二氧化碳的反应 。
②二氧化碳与水反应 。
(1)实验一:
步骤一:室温下,取大小相同的两个集气瓶,用向上排空气法收集两瓶二氧化碳气体,小心地由瓶壁向瓶中各加入半瓶蒸馏水,瓶1用玻璃片盖好,瓶2盖上胶塞迅速振荡后,取下胶塞盖好玻璃片,两瓶静置相同的时间。
步骤二用燃着的木条同时伸入两瓶,观察到瓶1中的木条熄灭比瓶2中的快。
[实验结论]该实验说明,二氧化碳溶于水的量的多少与 (填字母序号)有关。
A.水量的多少 B.水的温度
C.气体与水的接触面积 D.气体与水的接触时间
[实验二]
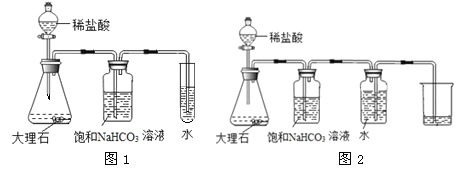
室温下,用图1所示装置向试管内长时间通入二氧化碳;用图2所示装置,收集一瓶二氧化碳。用pH计测得室温下三种液体的pH,记入下表。
液体 | 所用蒸馏水 | 试管内 | 烧杯内 |
pH | a1 | a2 | a3=6.94 |
[实验结论]
由a3数据可知,用图2所示装置收集二氧化碳时,二氧化碳在水中溶解的量很小。
根据上述结论,推测a1、a2和a3由小到大的顺序是 。
[反思与交流]饱和碳酸氢钠溶液的作用是 。
[实验结论]用图2所示装置,可以收集二氧化碳。