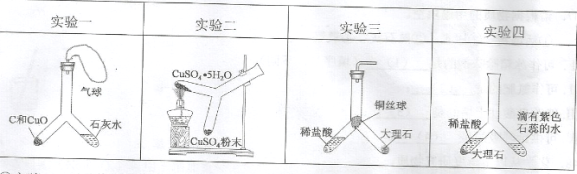
题目内容
【题目】某同学用稀硫酸、氢氧化钠溶液、酚酞溶液三种试剂,按如图所示进行酸碱中和反应的实验.
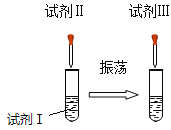
①在盛有试剂Ⅰ的试管中,先后加入试剂Ⅱ、试剂Ⅲ,同时不断振荡,观察到溶液先变红后变无色。试剂Ⅱ是 (8) 。
②上述实验过程中:溶液的 (9) 减弱,这是由于 (10) ,由此证明上述实验过程确实发生了化学反应,写出反应的化学方程式 (11) 。
③取上述实验后的无色溶液少许于试管中,加入合适的试剂,可验证化学反应是否恰好完全反应,下列中不能加入的试剂是 (12) 。
A.石蕊溶液 B.铜片 C.氧化铁 D.硝酸钡溶液
【答案】(8)酚酞
(9)碱性
(10)氢氧化钠减少了(合理给分)
(11)H2SO4+2 NaOH====Na2SO4+2H2O
(12)BD(答全给分)
【解析】
试题分析:(8)根据溶液先变红后变无色可知,试剂I为氢氧化钠溶液,试剂II为酚酞,碱溶液能使酚酞试液变为红色,试剂III为稀硫酸;
(9)向氢氧化钠溶液中加入稀硫酸,生成硫酸钠和水,说明溶液的碱性逐渐减弱;
(10)碱性减弱原因是氢氧化钠和稀硫酸发生了反应,
(11)氢氧化钠和稀硫酸反应,生成硫酸钠和水;
(12)A、若石蕊溶液不变色,说明氢氧化钠和稀硫酸恰好完全反应,正确;B、铜片与稀硫酸、氢氧化钠都不发生反应,无明显现象,错误;C、氧化铁为红棕色,若红棕色逐渐消失,溶液由无色变为黄色,证明稀盐酸有剩余,错误;D、氢氧化钠与稀硫酸反应,生成的硫酸钠与硝酸钡溶液反应,也能生成硫酸钡,无法验证硫酸是否过量,错误。故选BD

【题目】(5分)结合教材中关于二氧化碳收集方法的描述:二氧化碳能溶于水,一般不用排水法收集。某化学小组分成两组进行实验,研究是否能用排水法收集二氧化碳的问题。
[查阅资料]二氧化碳不溶于饱和碳酸氢钠溶液。
[知识储备]写出下列化学方程式:
①实验室制备二氧化碳的反应 。
②二氧化碳与水反应 。
(1)实验一:
步骤一:室温下,取大小相同的两个集气瓶,用向上排空气法收集两瓶二氧化碳气体,小心地由瓶壁向瓶中各加入半瓶蒸馏水,瓶1用玻璃片盖好,瓶2盖上胶塞迅速振荡后,取下胶塞盖好玻璃片,两瓶静置相同的时间。
步骤二用燃着的木条同时伸入两瓶,观察到瓶1中的木条熄灭比瓶2中的快。
[实验结论]该实验说明,二氧化碳溶于水的量的多少与 (填字母序号)有关。
A.水量的多少 B.水的温度
C.气体与水的接触面积 D.气体与水的接触时间
[实验二]
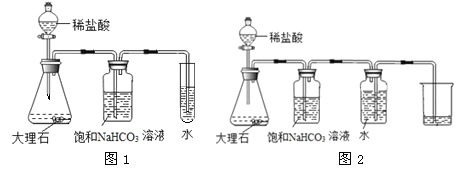
室温下,用图1所示装置向试管内长时间通入二氧化碳;用图2所示装置,收集一瓶二氧化碳。用pH计测得室温下三种液体的pH,记入下表。
液体 | 所用蒸馏水 | 试管内 | 烧杯内 |
pH | a1 | a2 | a3=6.94 |
[实验结论]
由a3数据可知,用图2所示装置收集二氧化碳时,二氧化碳在水中溶解的量很小。
根据上述结论,推测a1、a2和a3由小到大的顺序是 。
[反思与交流]饱和碳酸氢钠溶液的作用是 。
[实验结论]用图2所示装置,可以收集二氧化碳。