题目内容
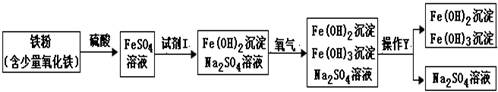
如图是氧化沉淀法生产复印用高档Fe2O4的部分工艺流程简图.

(1)试剂Ⅰ和操作Y的名称分别为________、________.操作Y中所用的玻璃仪器有:玻璃棒、烧杯和________.
(2)写出第①步中任意一个反应的化学方程式________.第②步反应的类型是________.
(3)往铁粉(含少量氧化铁)中加入试剂Ⅰ,除铁、氧化铁与试剂Ⅰ发生反应外,一定还发生其它反应.作出这种判断的依据是________.
解:(1)Fe与试剂1生成了硫酸亚铁,根据复分解反应的特点可以知道试剂I为稀硫酸;分离液体和固体的常用操作是过滤,所用的玻璃仪器有:玻璃棒、烧杯和漏斗;
(2)硫酸和铁反应生成硫酸亚铁和氢气,反应的方程式为Fe+H2SO4=FeSO4+H2↑;硫酸与氧化铁反应的方程式为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;硫酸亚铁和氢氧化钠反应生成氢氧化亚铁和硫酸钠,是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
(3)氧化铁与硫酸反应要生成硫酸铁,而图中反应后的物质中只有FeSO4,可见一定发生了我们并不知道的反应.
故答案为:
(1)稀硫酸、过滤;漏斗;
(2)Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;复分解反应;
(3)所得溶液中只有一种FeSO4溶质.
分析:根据复分解反应的特点,由硫酸亚铁溶液转化为氢氧化亚铁、氢氧化铁和硫酸钠可以得出试剂I为氢氧化钠溶液.将混合物中沉淀和溶液分开的操作是过滤.酸与金属氧化物发生复分解反应.由我们初中知识可知往铁粉(含少量氧化铁)中加入硫酸,铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应.
点评:熟练掌握铁和铁的氧化物的化学性质,同时能够从题给的条件中获取我们想要的信息,并根据所获信息解题得出正确的结论.
(2)硫酸和铁反应生成硫酸亚铁和氢气,反应的方程式为Fe+H2SO4=FeSO4+H2↑;硫酸与氧化铁反应的方程式为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;硫酸亚铁和氢氧化钠反应生成氢氧化亚铁和硫酸钠,是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
(3)氧化铁与硫酸反应要生成硫酸铁,而图中反应后的物质中只有FeSO4,可见一定发生了我们并不知道的反应.
故答案为:
(1)稀硫酸、过滤;漏斗;
(2)Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;复分解反应;
(3)所得溶液中只有一种FeSO4溶质.
分析:根据复分解反应的特点,由硫酸亚铁溶液转化为氢氧化亚铁、氢氧化铁和硫酸钠可以得出试剂I为氢氧化钠溶液.将混合物中沉淀和溶液分开的操作是过滤.酸与金属氧化物发生复分解反应.由我们初中知识可知往铁粉(含少量氧化铁)中加入硫酸,铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应.
点评:熟练掌握铁和铁的氧化物的化学性质,同时能够从题给的条件中获取我们想要的信息,并根据所获信息解题得出正确的结论.

练习册系列答案
相关题目