题目内容
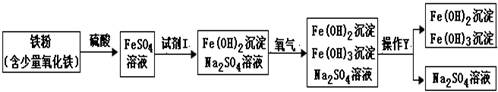
如图是氧化沉淀法生产复印用Fe3O4粉的工艺流程简图,根据要求回答问题.

(1)铁的另两种常见氧化物的化学式是
(2)副产品P是
a.过滤;b.加热浓缩;c.冷却结晶;d.晶体加热至完全失去结晶水
(3)通空气时的化学方程式是4Fe(OH)2+2H2O+O2
4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,控制“一定量空气”的目的是

(1)铁的另两种常见氧化物的化学式是
FeO、Fe2O3
FeO、Fe2O3
.(2)副产品P是
Na2SO4
Na2SO4
,由溶液N获得该副产品的操作顺序是b→c
c
→a
a
→d.a.过滤;b.加热浓缩;c.冷却结晶;d.晶体加热至完全失去结晶水
(3)通空气时的化学方程式是4Fe(OH)2+2H2O+O2
| ||
控制Fe(OH)2的转化量(或答:防止Fe(OH)2全部转化为Fe(OH)3)
控制Fe(OH)2的转化量(或答:防止Fe(OH)2全部转化为Fe(OH)3)
,沉淀M中Fe(OH)2 和Fe(OH)3的最佳质量比为45:107
45:107
.分析:(1)根据铁的化合价确定铁的氧化物的化学式.
(2)根据通入空气的作用进行分析;
(3)根据从硫酸钠溶液中分离出硫酸钠的方法分析操作过程;根据反应的质量比进行分析.
(2)根据通入空气的作用进行分析;
(3)根据从硫酸钠溶液中分离出硫酸钠的方法分析操作过程;根据反应的质量比进行分析.
解答:解:(1)铁的氧化物有氧化铁、氧化亚铁和四氧化三铁,故另外两种氧化物的化学式为:FeO Fe2O3
(2)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品P是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:b→c→a→d;
(3)因为通空气时的化学方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,即Fe(OH)2转化为Fe(OH)3,所以控制“一定量空气”的目的是控制Fe(OH)2与Fe(OH)3的质量比,以达到他们的最佳质量比.他们的最佳质量比就是能够高产得到Fe3O4,所以他们两者恰好完全反应时的质量比就是最佳质量比,由化学方程式Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,可知Fe(OH)2与Fe(OH)3的质量比的最佳质量比为:90:(2×107)═45:107.
故答案为:
(1)FeO、Fe2O3 (2)Na2SO4 c a
(3)控制Fe(OH)2的转化量[或答:防止Fe(OH)2全部转化为Fe(OH)345:107]
(2)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品P是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:b→c→a→d;
(3)因为通空气时的化学方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,即Fe(OH)2转化为Fe(OH)3,所以控制“一定量空气”的目的是控制Fe(OH)2与Fe(OH)3的质量比,以达到他们的最佳质量比.他们的最佳质量比就是能够高产得到Fe3O4,所以他们两者恰好完全反应时的质量比就是最佳质量比,由化学方程式Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,可知Fe(OH)2与Fe(OH)3的质量比的最佳质量比为:90:(2×107)═45:107.
故答案为:
(1)FeO、Fe2O3 (2)Na2SO4 c a
(3)控制Fe(OH)2的转化量[或答:防止Fe(OH)2全部转化为Fe(OH)345:107]
点评:本题是一道信息给与与生产实践相关的题型,以含铁的物质为基本出发点,引发出含铁的氧化物的种类,混合物的分离方法,产品的制作流程.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目