题目内容
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
|
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) |
| 第1次 | 20 | 17.4 |
| 第2次 | 20 | 14.8 |
| 第3次 | 20 | 12.2 |
| 第4次 | 20 | 12.0 |
| 第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为 70 ;
(2)黄铜样品中锌的质量分数为 71 ;
(3)所用稀硫酸中硫酸的质量分数是多少? 72
70. 12.0(或12) 71. 40% (每空1分)
72.[共3分,化学方程式1分,计算过程1分,结果1分(无计算过程不给分)]
解:设所用稀硫酸中硫酸的质量分数为x,据题意得:
Zn + H2SO4 = ZnSO4 + H2↑ …………1分
65 98
20g-17.4g=2.6g 20g·x
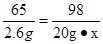 …………1分
…………1分
x=19.6% …………1分
答:所用稀硫酸中溶质的质量分数为19.6%。(合理解法均给分)
解析:略

练习册系列答案
相关题目
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
请回答下列问题:
(1)m= ;
(2)该黄铜样品中锌的质量分数为 ;
(3)所用稀硫酸中溶质的质量分数为 .
| 第一次 | 第二次 | 第三次 | |
| 加入稀硫酸的质量(g) | 50 | 50 | 50 |
| 生成氢气的质量(g) | 0.4 | m | 0.2 |
(1)m=
(2)该黄铜样品中锌的质量分数为
(3)所用稀硫酸中溶质的质量分数为
 (2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.