题目内容
【题目】(7分)为了分析生铁中铁的含量,某学习小组进行了实验研究:取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见图)。(说明:生铁中杂质不溶于水,不与盐酸反应 )
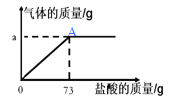
(1)实验中可观察到______________________。(写1条)
(2)铁完全反应用去盐酸的质量为 g。
(3)生铁中铁的质量分数为 (精确到0.1%)。
(4)A点表示的溶液的质量为多少?(写出求算过程)
【答案】(1)有气体生成;
(2)73;
(3)93.3%;
(4)78.4g
【解析】
试题分析:(1)铁与盐酸反应会产生大量的气泡,生成氯化亚铁和氢气;
(2)由盐酸质量与放出气体质量的关系图可知,铁完全反应用去盐酸的质量为73g;
(3)根据铁与盐酸反应的化学方程式,利用它们反应的质量比即可计算出生铁中铁的质量;
73g10%的盐酸中溶质的质量=73g×10%=7.3g
设生铁中铁的质量为x,
Fe + 2HCl == FeCl2 + H2↑
56 73
X 7.3g
56/73 =x/7.3g
X=5.6g
生铁中铁的质量分数=5.6g/6g ×100%=93.3%;
(4)A点表示铁与盐酸恰好完全反应,设此时生成的氢气的质量为y,
Fe + 2HCl == FeCl2 + H2↑
73 2
7.3g y
73/2 =7.3g/y
y=0.2g
A点溶液的质量=73g+5.6g-0.2g=78.4g
答:略

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目