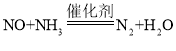题目内容
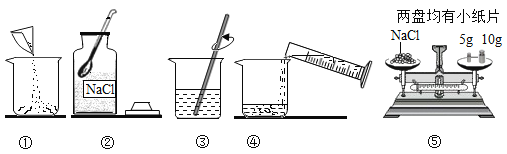
【题目】工业生产的纯碱中常含有少量NaCl杂质。化学课外活动小组同学为测定该纯碱样品中碳酸钠含量是否符合如图的标签要求,他们称取了纯碱样品11g,全部溶解在64.4g水中,向该溶液中加入一定量的稀盐酸恰好完全反应,生成气体4.4克。若将溶液蒸发50克水后,所得溶液的溶质质量分数为10%。计算:

(1)通过计算判断该纯碱中碳酸钠含量是否符合标签要求?(精确到0.1%)
(2)蒸发水后所得溶液的质量。
(3)所用稀盐酸中溶质的质量分数。
【答案】(1)不符合;(2)121g;(3)7.3%
【解析】
(1)设:纯碱样品中碳酸钠的质量为x,反应消耗氯化氢的质量为y,生成的氯化钠的质量为z。

![]()
![]()
![]()
x=10.6g y=7.3g z=11.7g
纯碱样品中碳酸钠的质量分数为:![]() ×100%≈96.4%<98%
×100%≈96.4%<98%
所以该纯碱样品中碳酸钠的质量分数不符合标签要求。
(2)反应后溶液中溶质的质量=11g-10.6g+11.7g=12.1g
蒸发水后所得溶液的质量=12.1g÷10%=121g
(3)加稀盐酸的质量=121g-11g-64.4g+4.4g+50g=100g
所用稀盐酸中溶质的质量分数=![]() ×100%=7.3%
×100%=7.3%
答:(2)蒸发水后所得溶液的质量为121g。
(3)所用稀盐酸中溶质的质量分数为7.3%。

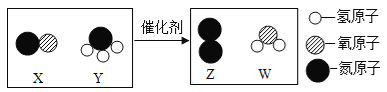
【题目】某固体混合物可能含有BaCl2、FeCl3、Mg(NO3)2、Na2SO4、CaCO3中的一种或几种,为确定其组成,兴趣小组进行如下探究,请你参与解答相关问题。

(1)分析图可知,固体混合物中不含有的物质是________。加入水后发生反应的化学方程式为____________
(提出问题)过滤所得无色溶液中含有哪些溶质?
(猜想与假设)猜想无色溶液中所含溶质可能为
猜想I: NaCl、Mg(NO3)2;
猜想II: NaCl、BaCl2;
猜想III: NaCl、Na2SO4;
猜想IV: NaCl、Mg(NO3)2、______
猜想V:含有NaCl、Mg(NO3)2、BaCl2。
(实验探究)
实验操作 | 实验现象 |
①取少量无色溶液于试管中,向其中滴加氢氧化钡溶液 | 产生白色沉淀 |
②在①反应后的试管中,加入足量的稀盐酸 | 白色沉淀部分溶解 |
(结论和反思)
(2)根据探究结果可知,猜想______成立, 步骤②沉淀溶解的化学方程式为_________
(3)若步骤②的现象为“白色沉淀全部溶解”,则该实验探究及步骤设计存在不足,因为这种情况下无法判断猜想_____和猜想_____哪个成立。