题目内容
【题目】如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
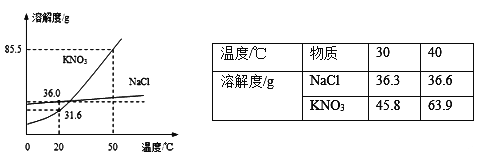
(1)20℃时,KNO3的溶解度是______g;
以下实验中:10mL水 ![]() x
x ![]() y
y ![]() z
z
x、y、z中一定为饱和溶液的是______。
(2)将z溶液降温到20℃时,所得溶液的质量分数为__________(保留一位小数);
(3)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是________________。
(4)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、蒸发浓缩、______,然后过滤、洗涤、干燥。
【答案】 31.6 y 24.0% 蒸发溶剂至饱和或加氯化钠固体至不再溶解 降温结晶
【解析】本题主要考查
固体溶解度曲线及其作用;混合物的分离方法,饱和溶液和不饱和溶液。可根据溶解度的观察方法和饱和溶液的判断方法考虑。
(1)从20℃向上作垂线与硝酸钾曲线的交点,再向纵坐标作垂线,正好对应31.6g,所以硝酸钾在该温度下溶解度为31.6g;因为20℃时硝酸钾在该温度下溶解度为31.6g,即10mL水中最多溶解3.16g;第一次加入2.5g,没有达到饱和,再加入2.5g,成了5g,所以已经饱和了,且没有全部溶解;升温到50℃,溶解度变为85.5g,即能溶解8.55g;加入的才5g,所以升温后不饱和,故饱和溶液只有y;
(2)将z溶液降温到20℃时,这时溶液只能溶解3.16g,质量分数为:3.16g/(10g+3.16g)*100%=24%。故填:24%
(3)不饱和溶液变为饱和溶液的方法有:加溶质、蒸发溶剂、降低温度。故填:蒸发溶剂至饱和或加氯化钠固体至不再溶解
(4)由于硝酸钾的溶解度随温度的升高而增大,而且受温度的影响很大,而氯化钠的溶解度受温度的影响很小,提纯混有少量氯化钠的硝酸钾时,主要采取降温结晶的方法.故填:降温结晶

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】某兴趣小组同学准备进行常见酸、碱、盐性质实验时,发现实验台上有一瓶失去瓶塞并且标签破损的液体药品(如图),于是决定对这瓶溶液的成分进行实验探究:
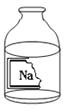
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含钠元素的物质是氯化钠、氢氧化钠、碳酸钠。
【提出猜想】这瓶溶液可能是:
①氯化钠溶液; ②氢氧化钠溶液; ③碳酸钠溶液。
【实验推断】
实验 | 实验操作 | 实验现象 | 实验结论和解释 |
(1) | 取样于试管中,滴加无色酚酞试液。 | 溶液呈红色 | 该溶液不可能是___________溶液, 理由是____________。 |
(2) | 另取样于试管中,滴加足量稀盐酸。 | _________ | 该溶液为碳酸钠溶液 |
(3)小青认为上述实验(2)的结论不完全正确,小组同学讨论后一致认为还需要进行如下实验:另取样于试管中,加入过量的中性CaCl2溶液,观察到有白色沉淀产生,设计这一步骤的目的是_______________;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液原来是____________。