题目内容
【题目】下面是几种实验室制取气体的发生装置和收集装置。请回答下列问题:
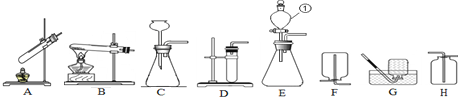
(1)写出标号仪器的名称:① 。
(2)小强用高锰酸钾制取氧气,他应选择上述装置中的 (填序号,下同)作为发生装置。你认为该装置中还缺少 。小强同学在实验过程中导致试管破裂,其原因可能是 、 (要求填写两点)。
反应的文字表达式为 ,属于 反应(填基本反应类型)。
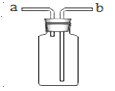
(3)小红选用过氧化氢溶液和二氧化锰制取氧气,要较好地控制产生氧气的速度,则发生装置应选用 ,反应的文字表达式是 ,若要收集较为纯净的氧气,则选用装置 。她若用如图所示装置进行排空气法收集氧气,气体应从 (填“a”或“b”)端通入,验满的方法是 。
(4)实验室常用无水醋酸钠和碱石灰的固体混合物在加热条件下制取甲烷气体,发生装置可选择 。甲烷气体一般采用装置G进行收集,收集满后集气瓶的放置方式如图所示,据此可推断甲烷一定具有的物理性质是: 、 。

(5)小明通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,小明应选择上述装置中的 作为发生装置(气密性良好)直接进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是 。
(6)小华想继续探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | ? | 67 |
实验3中,加入的二氧化锰质量为 g。
相同条件下,实验3产生氧气的速率最快,说明 。
【答案】(1)长颈漏斗。
(2)B 棉花团 没有预热、试管外壁有水,未经擦干就直接加热(或试管底部触及灯芯)。![]() ,分解。
,分解。
(3)E,![]() ,G b,将一根带火星的木条放在b导管口处,如果木条复燃,说明氧气已满。
,G b,将一根带火星的木条放在b导管口处,如果木条复燃,说明氧气已满。
(4)B 难溶于水(或不易溶于水)、密度比空气小。
(5)A 氧气中混有较多的水蒸气。
(6)①5②相同条件下,反应物浓度越大,反应速率越快(或相同条件下,过氧化氢浓度越大,过氧化氢分解速率越快)。
【解析】
试题分析:(2)加热固体制取气体时应使用装置B;为防止高锰酸钾颗粒堵塞导管,常需要在试管口放一团棉花;给试管中的固体加热,导致试管炸裂的原因有:没有预热、试管外壁有水,未经擦干就直接加热或试管底部触及灯芯等;高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰、氧气,一变多,是分解反应类型;
(3)分液漏斗能控制液体的滴加速率,而控制生成气体的速率。排水法收集的气体较纯;氧气的密度比空气大,应从b进入;氧气有助燃性,能使带火星的木条复燃,通常将一根带火星的木条放在b导管口处,如果木条复燃,说明氧气已满。
(4)加热固体制取气体时应使用装置B;采用装置G进行收集,说明甲烷难溶于水,瓶口向下放置,说明甲烷的密度比空气的小;
(5)加热液体制取气体时应使用装置A;试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是在加热时产生水蒸气较多,使氧气和木条不能充分接触,导致带火星的木条不复燃;
(6)为控制变量,实验3中加入二氧化锰的质量应该也是5克;实验3所用过氧化氢溶液最多,但是加水最少,既实验3过氧化氢溶液浓度最大,实验3产生氧气的速率最快,说明相同条件下,反应物浓度越大,反应速率越快(或相同条件下,过氧化氢浓度越大,过氧化氢分解速率越快)。

【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO(氧化铜)能否起到类似MnO2的催化剂作用呢?于是进行了以下探究:
【猜想】
Ⅰ、CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ、CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后 。
【实验】用天平称量0.2g CuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
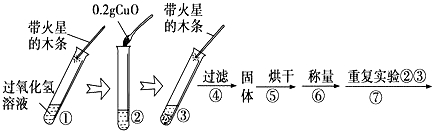
(1)填写下表:
实验步骤3现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
, 带火星的木条复燃。 | 溶液中有气泡放出, | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立 |
(2)步骤1的目的是 ;
(3)步骤④需用到的实验仪器有: ;
(4)过氧化氢能被CuO催化分解放出O2的文字表达式为 。