��Ŀ����
����ͭ������ũҵɱ�������ͼ�����ú�����ͭ����������ͭ�Ĺ��գ��ش��������⣮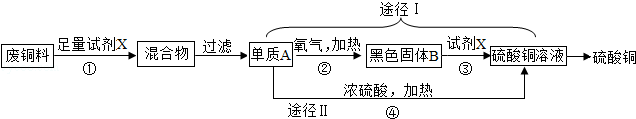
��1���Լ�X�Ļ�ѧʽ���� ����
��2��;�����У�Cu+2H2SO4����Ũ��  CuSO4+SO2��+2H2O�ӻ����;��õĽǶȷ���������;���� ����
CuSO4+SO2��+2H2O�ӻ����;��õĽǶȷ���������;���� ����
�������ȡ����ͭ��������
��3��ͨ������²���Ӧ���������ʣ��ڸı��¶Ⱥ��� ����Ҳ���ܷ�����Ӧ�������������ͭ��20.0������������Ϊ98.0%��Ũ�����ڼ��������³�ַ�Ӧ��ʵ�����ɶ���������������� ����ѡ����ĸ����
A����6.4g B������6.4g C������6.4g
��1��H2SO4��
��2����
��3����Ӧ���Ũ�ȣ�A
���������������1����ͭ���к�����������Ҫ�Ƶ�����ͭ��Ӧ���Ȱ�����ȥ����ȥ��Ӧ��ѡ��ϡ���
��2��;������Ϊ��������ͭ�������ڼ������������ɺ�ɫ��������ͭ������ͭ��ϡ���ᷴӦ��������ͭ��;��II��ͭ��Ũ���ᷴӦҪ���ɶ����������Ⱦ�������ҷ�Ӧ����������Ũ����Ũ�ȵļ�С����Ӧ��Խ��Խ������������˷ѣ�����Ӧ��ѡ��;��I��
��3��ͭ��ϡ�����Ӧ�����ܺ�Ũ���ᷴӦ���ʷ�Ӧ����Ũ�����н��еģ�
��20.0g������������Ϊ98.0%��Ũ�����ڼ�����������ͭ��ȫ��Ӧ�����ɶ������������Ϊx
Cu+2H2SO4����Ũ�� 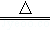 CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
196 64
20g��98.0% x
x=6.4g
�����ȫ��Ӧ���ݻ�ѧ����ʽ���Լ����Ӧ������6.4g���壬�������ŷ�Ӧ�Ľ���Ũ������ϡ����ʹ��Ӧ��ֹ������������6.4g��������ʵ�������ɵ�����ҪС��6.4g
���㣺���ʵ��ת�����Ʊ��������Ļ�ѧ���ʣ�
������������������ͼ����ȷ����ÿ�������������е����ã��Ӷ��ﵽȫ�������������̵�Ŀ�ģ�Ϊ���������������

 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д��ִ��˶�����Ʒ�ʵ�Ҫ��Խ��Խ�ߣ�ʳƷ���Ӽ�ҲӦ�˶�����
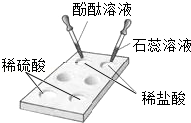
��1������±�㶹����һ�オһ���������е���±��������Ϊ�ı�ʳƷ״̬�����ӵ����̼�����±����Ҫ�ɷ����Ȼ�þ����ˮ�к��зḻ��ʳ�κ��Ȼ�þ������롢�ᴿ������ͼ��ʾ��
��ͼ�ش𣺴����к��д�����ɳ���Ӵ����ᴿ���εIJ������� ������ ������ ����д�����з����Ļ�ѧ��Ӧ����ʽ�� ����
��2������ȷ�����Ͱ�ȫʹ��ʳƷ���Ӽ��dz���Ҫ���±���ij�������������ֲ�ͬƷ�Ƴ�֭�ı�ǩ��
AƷ������֭��Ʒ ���ϣ�����ˮ����ɰ�ǣ���Ũ��֭��ɽ���ᣬ��������ʳ���㾫 ��֭������10% �����ڣ�12���� �������ڣ�2013��1��29 |
BƷ������֭��Ʒ ���ϣ�����ˮ����Ũ��֭��ɽ�����֭������90% �����ڣ�12���� �������ڣ�2013��1��29 |
��ii����ѡ���Ʒ�Ƹ������ڣ��� �����A����B������Ϊ�������Ӽ���Σ����ѡ����װʳƷʱӦע���� ��������дһ������
��3��Ϊά��ʳƷ��ȫ�����������棬��2011��5��1���𣬽�ֹ��������������������Ӽ�����ý�屨����������ȼ�գ�һЩ����ݴ˵��������м����˲���ȫ�����Ӽ�������������ȼ���жϼ��������Ӽ��Dz���ѧ�ģ���Ϊ����к��еĵ����ǿ���ȼ�յģ����۵Ļ�ѧʽΪ��C6H10O50����ȫȼ�յIJ������� ����ȼ�չ����п��ŵ���ͷ���ս��ƵĴ̱���ζ��������е�Ӫ������ ��ȼ�ղ����ģ�
��4����۲�������ȼ�գ�һ�������»��ᷢ����ը��������۹�����Ӧע��������� ������дһ������
(7��)ij��ѧ�С���ԡ�����ε����ʡ�Ϊ�������̽����ѧϰ��������Ϊ��С���Աһ��������������⣺
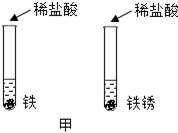
��1���������ƹ�����¶�ڿ����У���������ˮ�ֶ�ʹ���渲��һ����Һ����һ�����ֽС����⡱��������������������������һ�仯�Ļ�ѧ����ʽ�ɱ�ʾΪ.�� �������� �����������������ƹ�������ܷⱣ�档.
��2��С��ͬѧ����ͼ�ܽ���NaOH��������ѧ���ʣ���NaOH�����������ܹ�������ѧ��Ӧ��
I.Ϊ����֤��Ӧ�٣�С������ɫʯ����Һ����NaOH��Һ�У���Һ����� ��
II. Ϊ����֤��Ӧ���Ƿ�������ѡ��������������� ����
| A��Na2CO3�������� | B��HCl�������� | C��FeCl3 | D��Ba(NO)2 |
��.��Ӧ�������������п�Ӧ����_______________________________________��
��.С��ͨ��ʵ����֤��Ca��OH��2Ҳ�����ƵĻ�ѧ���ʣ��ɴ˵ó��������ƵĻ�ѧ���ʣ���Ľ����ǣ� ��
��7�֣�ʵ��������һƿ���õ���ɫ��Һ���ܲ��������ȱ�ı�ǩ��ֻʣ�¡�Na���͡�10%����������ͼ��ʾ����
Сǿ��С��ͬѧ�ܸ���Ȥ����������ɷֽ���̽����
��������⡿��ƿ�Լ�������ʲô��Һ�أ�
���������ۡ����������ǩ������жϣ���ƿ�Լ��������� �� ��
A���� B���� C����
���������ϡ�
����г������ƵĻ������У�NaCl��NaOH��Na2CO3��NaHCO3��
��Na2CO3��NaHCO3��ˮ��Һ���ʼ��ԣ�
�����£�20�棩ʱ���ⶨ�������ʵ��ܽ���������£�
| ���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
| �ܽ��g | 36 | 109 | 215 | 9.6 |
���������롿�ٿ�����NaCl���ڿ�����Na2CO3���ۿ�����
��ʵ��̽����
��1��Сǿ�ýྻ�IJ�����պȡ��Һ��pH��ֽ�ϣ����pH��7������ƿ�Լ���������
��2��СǿΪ�˼������Һ��NaOH��Һ����Na2CO3��Һ�����ֽ���������ʵ�飮
| ʵ�鲽�� | ʵ������ | ���ۼ���ѧ����ʽ |
| ȡ������Һ���Թ��У��μ� | ������������ | ��Ӧ�Ļ�ѧ����ʽ�� |
| �Ѳ���������ͨ������ʯ��ˮ�У� | �����ʯ��ˮ����� | �������ȷ�� ��Ӧ�Ļ�ѧ����ʽ�� |
��10�֣���ʮһ�����Ǻ��������õ����ͣ�ij�й滮ȷ���ˡ���ɫ���á���չս�ԣ�����ѧ��Դ���ۺ����ý����ص㷢չ����֮һ��������ij�о���ѧϰС����̽����ˮ�ۺ����������������⣬�������̽����
����һ����ˮ��þ��������θ���þ���ӣ�
�ס��ҡ�����λͬѧ��������Լ������룺
�ף�ֱ������ˮ�м���ʯ���顣
�ң����¼���������ˮ����ʯ���顣
������ɹ�κ��±ˮ�У�����ʯ���顣
ͨ�������Ƚϣ�����Ϊ___________��������Ϊ���ú�����ѡ��ס������ҡ���������
������������ᴿ��������γ�ȥ���������ʣ�
���������ϡ�
�����к��������ơ��Ȼ��Ƶȿ��������ʡ�
�����ʵ�顿
�ᴿʱ���������ˮ�мӹ���������������Һ��Ŀ����_____��________���ټӹ�����____��______���������������ӣ���ȥ����������Һ�м���__��_____������Һ��pH��Ϊ7�����õ�����ˮ��
����������ˮ���Ƽ �IJ���ɷ���ʲô��
ͬѧ�Ǵ�ij��ҵȡ������̼������������ȫ�ֽ��Ĺ�����Ʒ��Ϊȷ����ɷ֣�����
������̽����
��������롿
�IJ��룺��Ʒ��ֻ����̼���ƣ�
�ҵIJ��룺��Ʒ��ֻ�����������ƣ�
���IJ��룺��Ʒ�к���̼���ƺ��������ơ�
���������������ֲ���Ŀ�ѧ������________________________________��
��ʵ�顢��¼�������
| ���� | ʵ����� | ʵ������ | ���� |
| 1 | ȡ������Ʒ���Թ��У���ˮ��ȫ �ܽ⣬�ټ���________________ | _____________________ | �ҵIJ��� ������ |
| 2 | ȡ����1��Ӧ�����Һ���Թ��� ___________________________ | ���������� | ֻ�м� ������� |
��ˮ���Ƽ�����չ��������̼���ơ�
�����ݷ�����
��ȡ�ص���Ʒ�м���200g7��3%��ϡ���ᣬǡ����ȫ��Ӧ�������ͬѧ�Ǵ����˶��ٿ˹�����Ʒ����Ҫ���н�����̣�