题目内容
归纳是化学学习的重要方法之一,在以下的归纳中你认为是正确或者是错误的,都请你按要求举例证明.
(1)中和反应生成盐和水,但生成盐和水的反应不一定是中和反应.(用化学方程式说明)
.
(2)分解反应就是一种物质生成两种物质的反应.(用化学方程式说明)
.
(3)合金都是由金属元素组成的.(用实例说明)
.
(4)盐溶液一定显中性.(用实例说明)
.
(1)对,CO2+2NaOH═Na2CO3+H2O;
(2)错,2KMnO4 K2MnO4+MnO2+O2 ↑;
K2MnO4+MnO2+O2 ↑;
(3)错,生铁和钢中含有C
(4)错,Na2CO3溶液显碱性.(本题答案仅供参考,其他合理答案合理即可)
解析试题分析:(1)中和反应是酸和碱反应生成盐和水,要素一是酸和碱反应,二是对应生成物为盐和水,两者缺一不可.所以该结论正确.对应的实例有二氧化碳与氢氧化钠或者氢氧化钙等的反应,也可以是酸和金属氧化物(如氧化铜或者是氧化铁等)发生的反应.
(2)分解反应是一种反应物生成多种生成物,而多种生成物既可以是两种也可以是两种以上的.所以该结论不正确.可以举例高锰酸钾的分解或者是铜绿的分解.
(3)合金是金属与金属或者是非金属熔合在一起得到的混合物,所以既可以是含有金属也可以是含有非金属元素.常见的合金不是金属和金属形成的例子有生铁,生铁是铁中含有碳元素的形成的合金.
(4)盐类物质在溶液中由于部分会发生水解,导致可能有的显酸性(如氯化铵),有的显碱性(如碳酸钠).
考点:中和反应及其应用;合金与合金的性质;盐的化学性质;分解反应及其应用.
点评:对于概念辨析性的结论,要抓住概念本身的要素去分析,如中和反应,既要是酸和碱反应,又要生成盐和水,两者必须同时满足.

 应用题作业本系列答案
应用题作业本系列答案(14分)某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
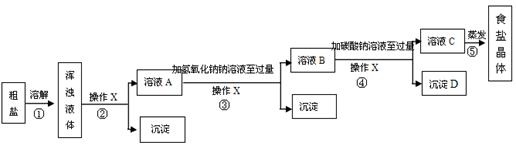
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(2)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(3)有同学认为原实验方案不完善,做出这种评价的依据是 。
二、用途之二:制备氯气。
工业上用电解饱和食盐水来制备氯气,可以得到多种化工产品,除氯气(Cl2)外,还生成密度最小的气体,向反应后的溶液中滴加无色酚酞试液,溶液变红,请写出发生反应的化学方程式 。
三、用途之三:工业制碱。
某厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
【相关资料】
⑴ NH4Cl△NH3↑+HCl↑
⑵已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【生产流程】如下
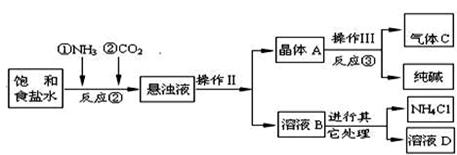
【问题讨论】:
(1)反应③中得到纯碱的化学方程式为: 。
(2)检验气体C的方法 。
(3)在反应②中,先通 气体,目的是 。
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算判断此纯碱样品的纯度为 。(保留一位小数)
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。


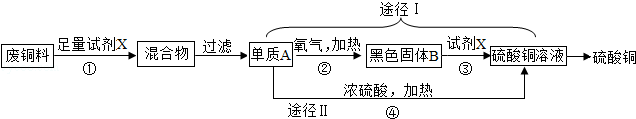
 CuSO4+SO2↑+2H2O从环保和经济的角度分析,利用途径 。
CuSO4+SO2↑+2H2O从环保和经济的角度分析,利用途径 。