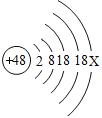
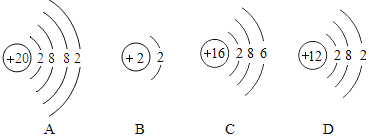
题目内容
【题目】根据下图回答有关问题:
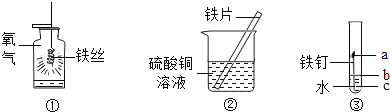
(1)写出实验①中反应的化学方程式_____,
(2)实验②中可观察到铁片的表面_____,说明铁的金属活动性比铜_____。(填“强”或“弱”)
(3)实验③中可观察到试管中铁钉最先生锈的是_____处。(填“a”或“b”或“c”)。
【答案】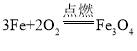 有红色物质生成 强 b
有红色物质生成 强 b
【解析】
(1)铁在氧气中燃烧生成四氧化三铁,该反应的化学方程式为: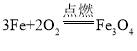 ;
;
(2)铁能与硫酸铜反应生成硫酸亚铁和铜,故可以看到,铁片表面有红色物质生成,溶液蓝色变浅,最后变成浅绿色溶液。铁能将铜从硫酸铜溶液中置换出来,说明铁的金属活动性顺序比铜强,故填:有红色物质生成,强;
(3)铁在与氧气、水蒸气共存的条件下更容易生锈,b处铁与氧气、水接触,故最易生锈,故填:b。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
【题目】某同学在学习溶液时进行了如下实验探究:
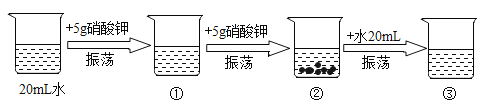
(1)上述实验所形成的溶液中,溶质是____.
(2)上述①②③烧杯的溶液,一定属于饱和溶液的是____[填烧杯编号].
(3)若要使烧杯②中的剩余固体全部溶解,除了实验中已经采取的措施外,还可以采取的措施为:____.
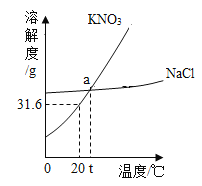
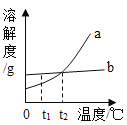
(4)图是氯化钠和硝酸钾两种固体物质的溶解度曲线,图中b表示的____溶解度曲线;在t1℃时,硝酸钾饱和溶液中溶质的质量分数____(填大于、小于或等于)氯化钠饱和溶液中溶质的质量分数.氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表:
0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
NaCl(g) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KNO3(g) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |