题目内容
化学兴趣小组取用浓度为7.3%稀盐酸测定某石灰石样品中碳酸钙的含量,取50g含样品(杂质不与盐酸、生成物反应,也不溶于水),滴加稀盐酸恰好完全反应,共生成17.6g二氧化碳.计算:
(1)石灰石中含碳酸钙的质量分数.
(2)最终所得溶液中溶质的质量分数.
(1)石灰石中含碳酸钙的质量分数.
(2)最终所得溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据碳酸钙与稀盐酸反应的方程式,由二氧化碳的质量可求出碳酸钙的质量及生成氯化钙的质量;
(2)根据以上计算及溶质质量分数的计算公式可求出反应后所得溶液中溶质的质量分数.
(2)根据以上计算及溶质质量分数的计算公式可求出反应后所得溶液中溶质的质量分数.
解答:解:设样品中含碳酸钙的质量为x,生成氯化钙的质量为y,消耗氯化氢的质量为z
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 111 44
x z y 17.6g
=
x=40g
=
z=29.2g
=
y=44.4g
(1)石灰石中含碳酸钙的质量分数:
×100%=80%
(2)7.3%稀盐酸的质量为:
=400g
反应后所得溶液中溶质的质量分数:
×100%=10.5%
答案:
(1)石灰石中含碳酸钙的质量分数80%
(2)反应后所得溶液中溶质的质量分数10.5%
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 111 44
x z y 17.6g
| 100 |
| 44 |
| x |
| 17.6g |
x=40g
| 73 |
| 44 |
| z |
| 17.6g |
z=29.2g
| 111 |
| 44 |
| y |
| 17.6g |
y=44.4g
(1)石灰石中含碳酸钙的质量分数:
| 40g |
| 50g |
(2)7.3%稀盐酸的质量为:
| 29.2g |
| 7.3% |
反应后所得溶液中溶质的质量分数:
| 44.4g |
| 40g+400g-17.6g |
答案:
(1)石灰石中含碳酸钙的质量分数80%
(2)反应后所得溶液中溶质的质量分数10.5%
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,难度较小.注意:根据化学方程式计算的方法、格式和步骤.

练习册系列答案
相关题目
石家庄“三鹿”公司在奶粉中添加违禁物质三聚氰胺,导致大批婴幼儿食用后患上肾结石,受到有关部门的严厉查处.下列关于三聚氰胺的性质中,属于化学性质的是( )
| A、它是一种纯白色晶体 |
| B、该物质的密度为1.573克/厘米3 |
| C、难溶于冷水,能溶于热水 |
| D、在高温下能分解成氰化物和氮气 |
在反应4Al+3MnO2
2Al2O3+3Mn中,作还原剂的物质是( )
| 高温 |
| A、Al |
| B、MnO2 |
| C、Al2O3 |
| D、Mn |
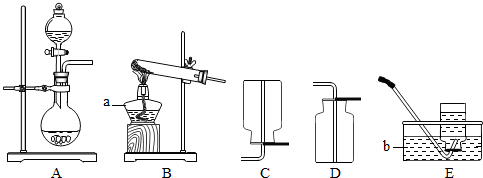
 某钙片的标签如右,且知钙片成分中只有碳酸钙中含有钙元素:
某钙片的标签如右,且知钙片成分中只有碳酸钙中含有钙元素: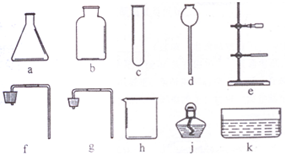 实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验.
实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验.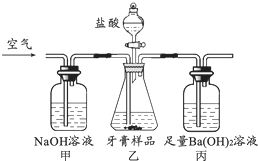 成人牙膏中摩擦剂的主要成分是碳酸钙.现通过以下实验装置测定碳酸钙的质量分数(假设牙膏的其它成分与盐酸不反应).
成人牙膏中摩擦剂的主要成分是碳酸钙.现通过以下实验装置测定碳酸钙的质量分数(假设牙膏的其它成分与盐酸不反应).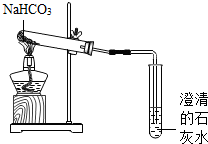 NaHCO3是一种重要的盐,设计实验探究其性质.
NaHCO3是一种重要的盐,设计实验探究其性质.