题目内容
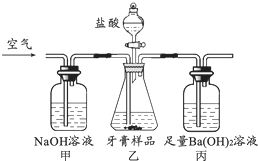 成人牙膏中摩擦剂的主要成分是碳酸钙.现通过以下实验装置测定碳酸钙的质量分数(假设牙膏的其它成分与盐酸不反应).
成人牙膏中摩擦剂的主要成分是碳酸钙.现通过以下实验装置测定碳酸钙的质量分数(假设牙膏的其它成分与盐酸不反应).①碳酸钙属于
②下列措施中不能提高测定准确度的是
A.缓慢地逐滴滴加盐酸
B.在甲、乙间增加装有浓硫酸的洗气瓶
C.在乙、丙间增加装有饱和碳酸氢钠溶液的洗气瓶
D.在乙装置反应结束后仍继续通入空气
③若称取的牙膏样品为a g,丙装置中的沉淀经干燥后质量为b g,则样品中碳酸钙的质量分数为
④若不测定丙装置中沉淀的质量,而通过测定丙装置在实验前后的质量差来计算碳酸钙的质量分数,会导致测定的结果明显偏高,原因是
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,常见的氧化物、酸、碱和盐的判别,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:①由金属离子和酸根离子组成的化合物是盐,并据碳酸钙和盐酸反应原理书写方程式;
②A、滴加盐酸过快,会导致生成的CO2不能完全被吸收,并被排出装置丙;
B、在甲乙间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2;
C、在乙丙之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2;
D、反应结束后仍继续通入空气可使生成的二氧化碳被全部排出,影响CO2;
③根据碳酸钡的质量求二氧化碳的质量,根据二氧化碳的质量求碳酸钙的质量,最后求质量分数,可利用方程式找出物质间的质量关系利用关系式求解;
④B中的水蒸气、氯化氢气体等进入装置C中会使溶液质量增加.
②A、滴加盐酸过快,会导致生成的CO2不能完全被吸收,并被排出装置丙;
B、在甲乙间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2;
C、在乙丙之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2;
D、反应结束后仍继续通入空气可使生成的二氧化碳被全部排出,影响CO2;
③根据碳酸钡的质量求二氧化碳的质量,根据二氧化碳的质量求碳酸钙的质量,最后求质量分数,可利用方程式找出物质间的质量关系利用关系式求解;
④B中的水蒸气、氯化氢气体等进入装置C中会使溶液质量增加.
解答:解:①碳酸钙由钙离子和碳酸根离子构成,属于盐,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②A、滴加盐酸过快,会导致生成的CO2不能完全被吸收,并被排出装置丙,所以缓慢地逐滴滴加盐酸,可使生成的CO2完全被吸收,提高实验的测定准确度;
B、在甲乙间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不影响实验的测定准确度;
C、在乙丙之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2,故不影响实验的测定准确度;
D、反应结束后仍继续通入空气可使生成的二氧化碳被全部排出,影响CO2的量,提高了实验的测定准确度;
③根据方程式CaCO3+2HCl═CaCl2+H2O+CO2↑、CO2+Ba(OH)2═BaCO3↓+H2O可知物质间的关系如下,设碳酸钙的质量为x
CaCO3→CO2→BaCO3↓
100 197
x bg
=
x=
g
所以碳酸钙的质量分数是:
×100%=
%
④乙中的水蒸气、氯化氢气体等进入装置丙中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高.
故答案为:①盐;CaCO3+2HCl=CaCl2+H2O+CO2↑;②BC;③
;④乙中的水蒸气、氯化氢气体等进入装置丙中,使溶液增重.
②A、滴加盐酸过快,会导致生成的CO2不能完全被吸收,并被排出装置丙,所以缓慢地逐滴滴加盐酸,可使生成的CO2完全被吸收,提高实验的测定准确度;
B、在甲乙间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不影响实验的测定准确度;
C、在乙丙之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2,故不影响实验的测定准确度;
D、反应结束后仍继续通入空气可使生成的二氧化碳被全部排出,影响CO2的量,提高了实验的测定准确度;
③根据方程式CaCO3+2HCl═CaCl2+H2O+CO2↑、CO2+Ba(OH)2═BaCO3↓+H2O可知物质间的关系如下,设碳酸钙的质量为x
CaCO3→CO2→BaCO3↓
100 197
x bg
| 100 |
| x |
| 197 |
| bg |
x=
| 100b |
| 197 |
所以碳酸钙的质量分数是:
| ||
| ag |
| 10000b |
| 197a |
④乙中的水蒸气、氯化氢气体等进入装置丙中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高.
故答案为:①盐;CaCO3+2HCl=CaCl2+H2O+CO2↑;②BC;③
| 10000b |
| 197a |
点评:本题能很好的考查学生对知识的掌握和应用,及分析、解决问题的能力,难度较大,要据相关知识结合具体情景仔细分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对一杯接近饱和的KNO3溶液,如要变成饱和溶液,可有多种方法,下列方法不能实现其转化的是( )
| A、蒸发H2O |
| B、加KNO3晶体 |
| C、降低温度 |
| D、升高温度 |
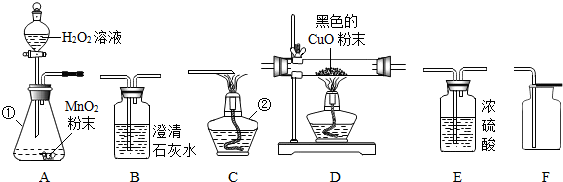

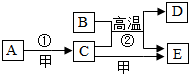 如图A~E为物质之间的转化关系,部分转化条件未流出.已知:A为黑色固体单质,B为红色粉末.A、D形成的合金是生产、生活中使用最多的金属材料,甲为常见的气体单质.请按要求完成下列空白:
如图A~E为物质之间的转化关系,部分转化条件未流出.已知:A为黑色固体单质,B为红色粉末.A、D形成的合金是生产、生活中使用最多的金属材料,甲为常见的气体单质.请按要求完成下列空白: