题目内容
【题目】某同学在做完K2CO3溶液与Ba(OH)2溶液反应的实验后,将试管中的剩余物一起.倒入含有氯化铁的废液缸中,看到“白色沉淀中混有红褐色沉淀”的现象。过滤,得无色溶液。
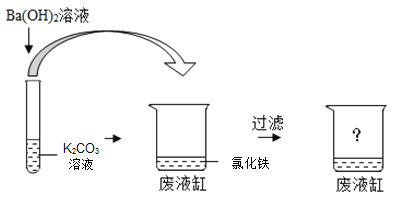
(1)写出试管中所发生反应的化学方程式____________________。
(2)为了确定所得无色溶液中溶质的组成,请你和同学们一起进行如下探究:取少量溶液于试管中,加入Na2SO4溶液,无明显现象。进行该实验的目的是为了检验溶液中是否含有__________________________ (填离子符号)。
探究过程中同学们提出了如下猜想,请完成猜想三。
猜想一:KCl和K2CO3
猜想二:KCl和KOH
猜想三:__________。
猜想四:KCl、K2CO3和KOH
查阅资料:CaCl2溶液呈中性;K2CO3溶液呈碱性。
同学们设计了如下实验方案:
方案1:取少量溶液于试管中,加入石灰水,再滴入酚酞溶液;
方案2:取少量溶液于试管中,加入足量的CaCl2溶液,再滴入酚酞溶液。
经过讨论后大家一致认为方案__________不合理,理由是____________________。
方案2中加入足量的CaCl2溶液的目的是____________________。
实验及结论:同学们用方案2进行实验,最后证明猜想四正确,则同学们在实验过程中观察到的现象是____________________。
【答案】![]() Ba2+ KCl 1 加入石灰水会引入 OH- ,无法确定原溶液中是否含有KOH 检验并完全除去K2CO3(或CO32- ) 有白色沉淀产生,溶液变为红色
Ba2+ KCl 1 加入石灰水会引入 OH- ,无法确定原溶液中是否含有KOH 检验并完全除去K2CO3(或CO32- ) 有白色沉淀产生,溶液变为红色
【解析】
(1)氢氧化钡和碳酸钾反应生成碳酸钡沉淀和氢氧化钾,反应的化学方程式为![]() ;
;
(2)加入Na2SO4溶液的目的是为了检验溶液中是否含有Ba2+,因为钡离子会和硫酸根离子形成硫酸钡沉淀;
加入硫酸钠溶液,无明显现象,说明溶液中不含钡离子,说明氢氧化钡已经完全反应,溶液为无色溶液,说明氯化铁已经完全反应,生成了氢氧化铁沉淀,故如果试管中碳酸钾过量,废液缸中氢氧化钾和氯化铁恰好完全反应,则溶质的组成为:氯化钾和碳酸钾;如果烧杯中碳酸钾和氢氧化钡恰好完全反应,废液缸中氢氧化钾过量,则溶质的组成为:氯化钾和氢氧化钾;如果试管中,碳酸钾和氢氧化钡恰好完全反应,废液缸中氢氧化钾和氯化铁恰好完全反应,则溶质的组成为:氯化钾;如果碳酸钾和氢氧化钾均过量,则溶质组成为:氯化钾、碳酸钾、氢氧化钾,故猜想三为:KCl;
方案1中加入石灰水引入了OH-,无法确定原溶液中是否含有KOH,因此方案1不合理;方案2加入足量的CaCl2溶液的目的是检验并完全除去K2CO3(或CO32- );
加入足量的CaCl2溶液,如果溶质中含有碳酸钾,则![]()
实验现象为有白色沉淀产生,向滤液中滴加酚酞溶液,如溶质中含有氢氧化钾,酚酞遇碱变红,故实验现象为溶液变为红色,如果猜想四正确,则实验现象为:有白色沉淀产生,溶液变为红色。