题目内容
【题目】下列化学方程式及反应类型均正确的是:( )
化学方程式 | 反应类型 | |
A | 2CO+O2═2CO2 | 化合反应 |
B | 2KMnO4 | 分解反应 |
C | 2Ag+H2SO4═Ag2SO4+H2↑ | 置换反应 |
D | BaCl2+CuSO4═BaSO4↓+CuCl2 | 复分解反应 |
A. AB. BC. CD. D
【答案】D
【解析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确
A、一氧化碳和氧气在点燃的条件下生成二氧化碳,应该有点燃的条件,正确的化学方程式为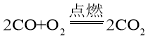 ,故A不正确;
,故A不正确;
B、高锰酸钾受热分解为锰酸钾、二氧化锰和氧气,正确的化学方程式为
![]() ,故B不正确;
,故B不正确;
C、银的活泼性较差,不能和硫酸反应,所以该反应不能发生,故C不正确;
D、氯化钡和硫酸铜反应生成硫酸钡和氯化铜,是两种化合物交换成分生成两种新的化合物,所以化学方程式和反应类型均正确,故D正确;故选D。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
【题目】根据表中内容回答下列问题。
温度 溶解度 物质 | 0 | 20 | 40 | 60 | 80 |
|
|
|
| 110 | 169 |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
![]() 随温度升高,
随温度升高,![]() 溶解度的变化趋势是______
溶解度的变化趋势是______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是______。
根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是______。
![]() 取
取![]() 、NaCl两种固体各36g分别放入
、NaCl两种固体各36g分别放入![]() 时的100g水中充分溶解,
时的100g水中充分溶解,![]() 时存在如图1所示的实验现象,烧杯b中溶解的物质是______;烧杯a所得溶液溶质的质量分数是______
时存在如图1所示的实验现象,烧杯b中溶解的物质是______;烧杯a所得溶液溶质的质量分数是______![]() 结果精确到
结果精确到![]() ,若要使其溶质质量分数增大可采用的方法是______。
,若要使其溶质质量分数增大可采用的方法是______。
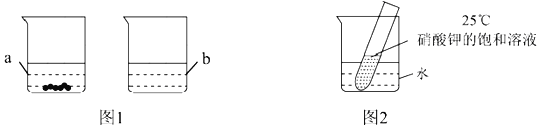
![]() 如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是______。
如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是______。