题目内容
浓硫酸与乙二酸(H2C2O4)在加热条件下反应的化学方程式为:H2C2O4 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
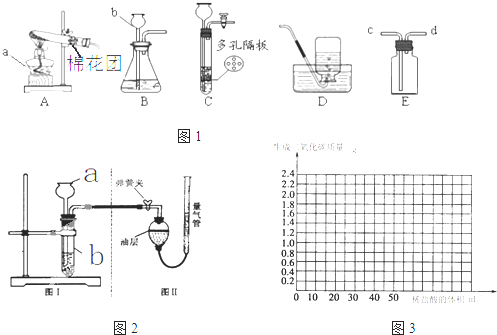
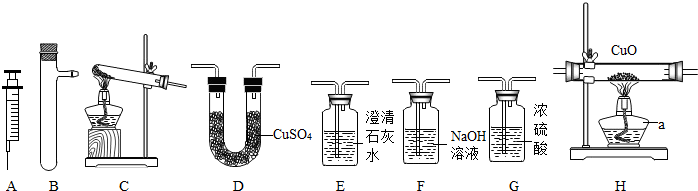
有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如图所示的装置.
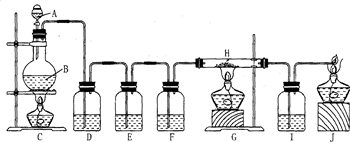
其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有Na0H浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末.
(一)(1)D装置的作用______.
(2)E装置的作用______.
(二)甲同学用上述装置,取不同质量的铁的氧化物进行实验.所得实验数据如下:
| 实验序号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 铁的氧化物质量(g) | 4.00 | 8.00 | 10.00 | 12.00 | 14.00 | 16.00 | 18.00 | 20.00 |
| 生成铁的质量(g) | 2.8l | 5.62 | 7.01 | 8.42 | 9.81 | 11.22 | 12.63 | 14.03 |
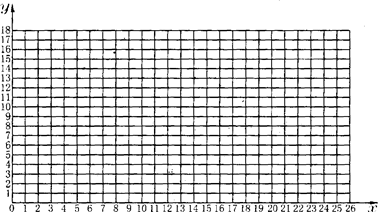
(1)如果以y轴表示生成铁的质量,x轴表示铁的氧化物质量,请用铅笔在坐标图上依次描出相应的实验数据的点.
(2)从上图可以看出甲进行第二次实验时,所得数据十分不可靠,故舍去.请分析造成此种结果的原因主要可能是______ 或______.
(3)请利用上图回答,第二次实验时生成的铁的质量约为______g(保留小数点后一位).
(4)如果另一同学乙取了25g铁的氧化物样品,而来不及做实验,但根据上述图示,可以求出所生成的铁的质量为______ g.(保留小数点后一位).将你所用的方法在上图中画出.
(5)同学丙看了甲、乙两同学所做的方法后,认为只要认真进行两次实验,就可回答上述问题.请用甲同学的两组实验数据用数学方法写出丙同学的分析过程.
(6)丁同学看了上述分析过程后,认为只要一组准确的实验数据就能解决问题.他是怎样分析的?
解:(一)(1)D中盛有Na0H浓溶液,可以吸收二氧化碳,反应中生成了二氧化碳气体,为防止二氧化碳干扰实验,就要用D中的Na0H浓溶液除去.
故答案为:除去混合气中的CO2.
(2)E中盛有澄清石灰水,可以检验二氧化碳的存在,D装置吸收完二氧化碳后,就要用E中的石灰水检验CO2是否已全部吸收.
故答案为:检验混合气中CO2是否已全部吸收.
(二)(1)根据题干表格中提供的实验数据找点描出即可,故答案为:
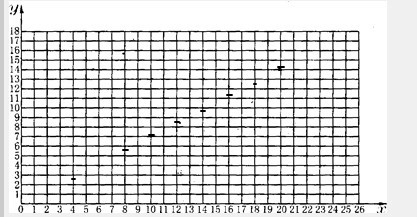
(2)甲进行第二次实验时,所得数据不十分可靠,可能的原因是反应的时间太短或温度太低造成反应不完全.
故答案为:反应时间太短或温度太低
(3)据表格可知,每20g氧化物生成铁的质量为14.03g,就是说含铁量为70.15%,而实验2中计算出的含铁量高,正常情况下8.00g铁的氧化物中含铁是:8.00×70.15%=5.6g
故答案为:5.6
4)25g铁的氧化物样品生成铁的质量可以在图上将点连线,作直线的延长线,数据大约为17.5,故填:17.5,在图上作直线延长线
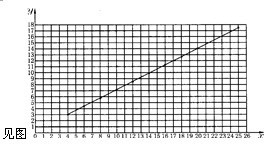
(5)根据题干提供的数据,选择铁的氧化物为4.00g和20.0g,可得直线方程为:2.81=4k+b,14.03=20k+b 解得k=0.70,b=0,所以 y=0.7x,当x=8时,y=5.6;当x=25时,y=17.5
(6)因为没有反应物就没有生成物,所以过原点的直线方程只能是 y=kx.
分析:(一)(1)D中盛有Na0H浓溶液,可以吸收二氧化碳;
(2)E中盛有澄清石灰水,可以检验二氧化碳的存在.
(二)(1)根据题干表格中提供的实验数据找点描出即可;
(2)反应的时间太短或温度太低都会造成生铁产量过高;
(3)根据实验一4g铁的氧化物生成铁的质量为2.81g,计算实验2中8g铁的氧化物生成铁的质量;
(4)25g铁的氧化物样品生成铁的质量可以在图上将点连线,得到生成的铁的质量;
(5)选择铁的氧化物为4.00g和20.0g时,进行分析;
(6)没有反应物就没有生成物,所以过原点的直线方程只能是 y=kx.
点评:本题考查了根据实验数据作图以及分析其他数据,完成此题,需要同学们结合数学知识,仔细审题.
故答案为:除去混合气中的CO2.
(2)E中盛有澄清石灰水,可以检验二氧化碳的存在,D装置吸收完二氧化碳后,就要用E中的石灰水检验CO2是否已全部吸收.
故答案为:检验混合气中CO2是否已全部吸收.
(二)(1)根据题干表格中提供的实验数据找点描出即可,故答案为:

(2)甲进行第二次实验时,所得数据不十分可靠,可能的原因是反应的时间太短或温度太低造成反应不完全.
故答案为:反应时间太短或温度太低
(3)据表格可知,每20g氧化物生成铁的质量为14.03g,就是说含铁量为70.15%,而实验2中计算出的含铁量高,正常情况下8.00g铁的氧化物中含铁是:8.00×70.15%=5.6g
故答案为:5.6
4)25g铁的氧化物样品生成铁的质量可以在图上将点连线,作直线的延长线,数据大约为17.5,故填:17.5,在图上作直线延长线

(5)根据题干提供的数据,选择铁的氧化物为4.00g和20.0g,可得直线方程为:2.81=4k+b,14.03=20k+b 解得k=0.70,b=0,所以 y=0.7x,当x=8时,y=5.6;当x=25时,y=17.5
(6)因为没有反应物就没有生成物,所以过原点的直线方程只能是 y=kx.
分析:(一)(1)D中盛有Na0H浓溶液,可以吸收二氧化碳;
(2)E中盛有澄清石灰水,可以检验二氧化碳的存在.
(二)(1)根据题干表格中提供的实验数据找点描出即可;
(2)反应的时间太短或温度太低都会造成生铁产量过高;
(3)根据实验一4g铁的氧化物生成铁的质量为2.81g,计算实验2中8g铁的氧化物生成铁的质量;
(4)25g铁的氧化物样品生成铁的质量可以在图上将点连线,得到生成的铁的质量;
(5)选择铁的氧化物为4.00g和20.0g时,进行分析;
(6)没有反应物就没有生成物,所以过原点的直线方程只能是 y=kx.
点评:本题考查了根据实验数据作图以及分析其他数据,完成此题,需要同学们结合数学知识,仔细审题.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
 a
a