题目内容
【题目】七水硫酸镁(MgSO47H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在湿热干燥空气中易失去结晶水,工业上将白云石(主要成分为MgCO3 , CaCO3)碳烧成粉,用于制取MgSO47H2O,工艺流程如图所示. 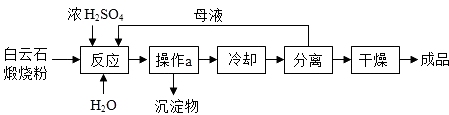
(1)煅烧过程中,MgCO3转化为MgO的基本反应类型是;
(2)写出MgO与H2SO4反应的化学方程式:;
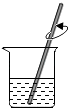
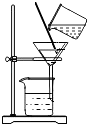
(3)操作a的名称为;
(4)将分离后的母液循环利用的目的是;
(5)干燥得成品时,需要控制的条件是 .
【答案】
(1)分解反应
(2)MgO+H2SO4=MgSO4+H2O
(3)过滤
(4)提高原料的利用率
(5)温度
【解析】解:(1)碳酸镁煅烧反应生成氧化镁和二氧化碳,属于分解反应;(2)碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳,化学方程式为:MgO+H2SO4=MgSO4+H2O;(3)操作a是过滤操作;(4)结晶后的母液是MgSO4的饱和溶液,循环利用母液可使原料中的镁元素最大可能地转化到产物中,因此将分离后的母液循环利用的目的是提高原料的利用率;(5)由于七水硫酸镁在湿热干燥空气中易失去结晶水,因此干燥得成品时,需要控制的条件是温度,以防止七水硫酸镁水解; 所以答案是:(1)分解反应;(2)MgO+H2SO4=MgSO4+H2O;(3)过滤;(4)提高原料的利用率;(5)温度.
【考点精析】利用过滤操作的注意事项和书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;注意:a、配平 b、条件 c、箭号.

练习册系列答案
相关题目