题目内容
人类的生存和发展离不开能源和资源。
(1)南京家用燃料的更新过程如下:
①下列有关家用燃料更新的理由,正确的是 (选填字母)。
A.天然气属于可再生能源
B.气体燃料比固体燃料利用率更高
C.天然气作为燃料可避免温室效应的发生
D.煤仅仅用作燃料烧掉浪费资源
②已知:同温、同压下,气体体积比等于分子个数比;管道煤气的主要成分是一氧化碳。原本以管道煤气为燃料的家庭若要改用天然气,灶具的改进方法可为 (选填字母)。
A.增大空气的进入量 B.增大天然气的进入量
C.减小空气的进入量 D.减小天然气的进入量
(2)水是生命之源,合理利用和保护水资源是我们义不容辞的责任。
①设法除去硬水中的 ,可以使硬水软化成软水。
②公共场所可利用“活性炭+超滤膜+紫外线”组合工艺获得直饮水,其中活性炭主要起 作用。
(3)海水中有大量可以利用的化学资源,其中所含的氯化镁是金属镁的重要来源之一。从海水中提取金属镁,可按下图流程进行: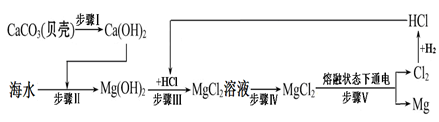
①下列有关说法正确的是 (选填字母)。
A.步骤Ⅰ通过一步反应即可实现
B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能
D.在此流程中涉及的基本反应类型有4种
②在此流程中可以循环利用的物质是 。
(1)①BD ②AD
(2)①钙、镁化合物(或钙、镁离子) ②吸附
(3)①B ②HCl
解析

(7分)我校实验室有一瓶保管不当的试剂,其残缺的标签中只剩下“钠”和“10%”字样(如图所示)。已知它是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究: 
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是下列三类物质中的 (填序号)。
A、酸 B、碱 C、盐
【查阅资料】 Ⅰ、初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ、测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 21.5 | 9.6 |
【做出猜想】①可能是NaOH溶液;②可能是 溶液;③可能是NaCl溶液。
【设计并实验】 (1)小强取样品少量,滴加无色酚酞试液,液体变红色他认为猜想①正确,他的判断是否合理 ,原因是 。
(2)小华为了检验该溶液到底是什么又进行了如下实验:取样品于试管中,滴加氯化钡溶液,有白色沉淀生成,他得出猜想②正确。相应的化学方程式 。
(8分)随着人们对酒驾危害认识的加深,司法机关对于酒驾、醉驾的处罚将日趋加重。醉酒的原因是酒中含有的乙醇对人的神经系统有刺激作用。交警对呼气酒精检验的原理是:橙色的K2Cr2O7酸性溶液遇乙醇会迅速变成蓝绿色。
白酒是乙醇的水溶液,酒中的乙醇在微生物作用下能被氧化成乙酸。小刚家有一瓶密封存放的白酒,他想知道该白酒的组成情况,于是进行如下实验探究:
【提出问题】该白酒中的溶质主要有哪些?
【查阅资料】材料一:乙醇(C2H5OH),俗称酒精,易溶于水,水溶液呈中性。在加热条件下,可以把氧化铜还原为单质铜。
材料二:乙酸(CH3COOH),又名醋酸,易溶于水,具有酸的通性。
【提出猜想】猜想1:只有乙醇
猜想2:只有乙酸
猜想3:
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量白酒于试管中,滴入几滴橙色的K2Cr2O7酸性溶液 | | 猜想3成立 |
| ② | |
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
久置固体中可能含有Ca(OH)2的原因是:
用化学方程式表示 。
实验探究1:甲同学的方案(见下表)。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有 和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量 的 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有 , 一定不含有Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 | | 固体中一定含有CaCO3 |
实验质疑:(1)乙同学认为甲同学的实验中的实验中不能得出一定含有Ca(OH)2的结论,理由是 。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是 。
实验探究2:乙、丙同学设计如下图所示实验方案继续验证。

(1)③中反应的化学方程式是 。
(2)乙、丙同学实验中又能得出固体样品中一定还含有 ,
仍有一种物质不能确定,该物质是 。
我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献。用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验。
资料摘要:碱石灰常用于吸收水蒸气和二氧化碳。
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加足量的CaCl2溶液。 | 产生白色沉淀 | 反应的化学方程式: |
(2)分析滴加的CaCl2溶液要足量的原因: 。
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3的质量分数为91%。如果不洗涤沉淀物会造成测定结果大于91%,这是因为 。
[方案二] 样品与稀盐酸反应,测定Na2CO3的质量分数利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。
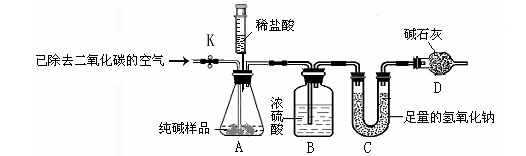
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的 ,再接上装置C和D。
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应)。待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿,目的是 。装置 (填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数。若没有装置D,将会使测定结果 (选填“偏大”或“偏小”)。
(6)某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g,放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。试计算:①生成二氧化碳的质量;②样品中Na2CO3的质量分数。(写出计算过程,结果保留一位小数)
老师在装有酸的储物柜中发现一瓶没有标签的溶液,让同学们鉴定该溶液是否为盐酸溶液。
| 实验步骤 | 实验现象 | 实验结论 |
| 1.取少量待测液体与试管中,滴加几滴石蕊溶液 | | 溶液呈酸性 |
| 2.取少量待测液与试管中,滴加 溶液 | 产生了白色沉淀 | 该待测溶液为盐酸 |
| 3.往上述2中的沉淀滴加 溶液 | |
写出上述操作2中所发生的化学方程式: 。
 ”表示两端的物质能发生反应,“
”表示两端的物质能发生反应,“ ”表示一种物质可转化为另一种物质。
”表示一种物质可转化为另一种物质。
 B的化学方程式
B的化学方程式