题目内容
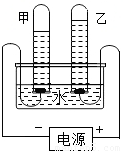
用如图所示的装置进行水的电解实验时,有以下描述:①向水中加入少量氢氧化钠,能使水电解产生气体的速度变大;
②甲、乙两试管内收集到的气体的体积比约为2:1;
③甲试管内产生的气体能燃烧,且燃烧时火焰呈淡蓝色;
④乙试管内产生的气体能使带火星的木条复燃.
以上描写中正确的是( )
A.①②③④
B.③
C.①②
D.①②③
【答案】分析:根据电解水实验的现象和结论回答,电解水时,为了增强水的导电性,常在水中加入少量硫酸和氢氧化钠,电源正极生成氧气,负极生成氢气,体积比为1:2,氢气能燃烧,发出淡蓝色火焰,氧气能使带火星的木条复燃.
解答:解:①向水中加入少量氢氧化钠,能使水电解产生气体的速度变大,因为氢氧化钠能增强水的导电性,此项正确;
②甲、乙两试管内收集到的气体的体积比约为2:1,符合理论值,正确;
③甲试管内产生的气体是氢气,氢气能燃烧,且燃烧时火焰呈淡蓝色,正确;
④乙试管内产生的气体是氧气,氧气能使带火星的木条复燃,正确.
故选A
点评:此题详细考查电解水的实验,电解水实验可简单记忆为:正氧负氢一比二,这里的比是体积比.
解答:解:①向水中加入少量氢氧化钠,能使水电解产生气体的速度变大,因为氢氧化钠能增强水的导电性,此项正确;
②甲、乙两试管内收集到的气体的体积比约为2:1,符合理论值,正确;
③甲试管内产生的气体是氢气,氢气能燃烧,且燃烧时火焰呈淡蓝色,正确;
④乙试管内产生的气体是氧气,氧气能使带火星的木条复燃,正确.
故选A
点评:此题详细考查电解水的实验,电解水实验可简单记忆为:正氧负氢一比二,这里的比是体积比.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
 30、陈纬同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问:
30、陈纬同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问:

 陈纬同学将浑浊的湖水样品倒入烧杯中,先加明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问:
陈纬同学将浑浊的湖水样品倒入烧杯中,先加明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问: