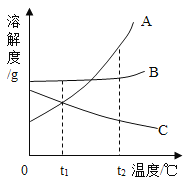
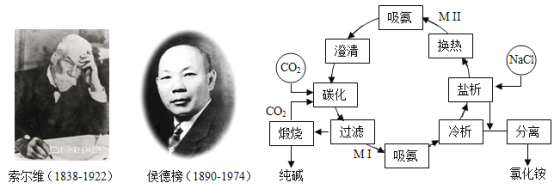
题目内容
【题目】向m克Zn和Fe的混合物中加入一定质量的 ![]() 溶液,充分反应后过滤,将滤渣洗涤、干燥后称量,质量仍为m g。对所得滤液和滤渣的判断正确的是( )
溶液,充分反应后过滤,将滤渣洗涤、干燥后称量,质量仍为m g。对所得滤液和滤渣的判断正确的是( )
A.滤液可能是无色B.滤渣中的物质可能有3种
C.滤液中一定有![]() 和
和![]() D.滤渣中加稀盐酸一定有气泡产生
D.滤渣中加稀盐酸一定有气泡产生
【答案】C
【解析】
由于金属的活动性是锌>铁>铜,将Zn和Fe的混合物中加入一定质量的CuCl2溶液,锌与先氯化铜反应生成氯化锌和铜,固体质量会减小,当锌反应完后,铁再与氯化铜反应生成氯化亚铁和铜,固体质量会增加,而反应后金属的质量不变,故铁一定参加了反应。
A、氯化亚铁的水溶液是浅绿色的,溶液不可能为无色,故A不正确;
B、铁参加了反应,则锌一定全部反应完,滤渣中不可能含有三种物质,故B不正确;
C、当锌反应完后,铁再与氯化铜反应生成氯化亚铁和铜,固体质量会增加,而反应后金属的质量不变,故铁一定参加了反应,则滤液中一定有ZnCl2和FeCl2,故C正确;
D、滤渣中不一定含有铁,故加入盐酸不一定有气泡产生,故D不正确。故选C。

【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的初中化学常见溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的探究.
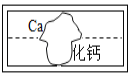
探究一:M溶液中的溶质是什么?
(提出猜想)该组同学认为M溶液的溶质可能是Ca(OH)2或_______。
(设计实验)同学们设计了如下方案并进行实验:
取少量M溶液于试管中,向其中________________。
结论:原溶液中的溶质是Ca(OH)2。
探究二:M和碳酸钠溶液反应过滤后澄清滤液中会有哪些溶质?
(提出猜想)
学生甲猜想:NaOH和Na2CO3;学生乙猜想:_________ ;学生丙猜想:NaOH。
(实验验证)甲同学针对自己猜想进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己猜想不成立,学生丙的猜想正确 |
甲同学的实验结论是否正确,为什么?_________________________。
(继续探究)为了证明自己猜想正确,丙同学设计的简单实验操作是:分别取两份滤液向其中一份溶液中_________;向另一份溶液中__________。
(总结交流)同学们意识到实验中一定要注意保护试剂瓶的标签。