题目内容
【题目】通过如下实验对稀硫酸部分化学性质进行验证,回答下列问题
实验一:Mg和稀硫酸
实验二:MgO和稀硫酸
实验三:Ba(NO3)2溶液和稀硫酸
实验四:KOH溶液和稀硫酸
(1)实验三中发生反应的化学方程式为_____。
(2)实验四无明显现象,再将打磨过的铁丝浸入该试验后的溶液中,仍无明显现象,据此_____(选填“能”或“不能”)验证KOH溶液和HSO4发生反应
(3)将上述所有实验后的溶液混合,并进行如下实验:
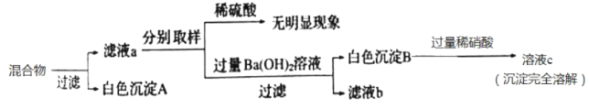
①写出滤液a中所含溶质的所有可能情况_____。
②分析上述实验,下列说法正确的是_____
A 用白色沉淀A一定能除去MgC12溶液中的少量盐酸
B 用白色沉淀B能检验CaCl2溶液中是否含有盐酸
C 用滤液b与适量的K2SO4溶液混合,过滤,制备KNO3溶液
D 向溶液c中加入过量的NaOH溶液或过量的NaCO3溶液都有明显的现象
【答案】Ba(NO3)2+H2SO4=2HNO3+BaSO4↓ 能 KNO3、Mg(NO3)2和KNO3、Mg(NO3)2、HNO3 BD
【解析】
(1)硝酸钡和硫酸反应生成硫酸钡沉淀和硝酸,化学方程式为:Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;
(2)加入铁丝后无明显现象,证明溶液中已经没有H2SO4,所以可证明H2SO4是与KOH溶液发生了反应;
(3)①根据实验一反应后的溶液中一定含有硫酸镁,可能含有硫酸;实验二反应后的溶液中一定含有硫酸镁,可能含有硫酸;实验三反应后的溶液中一定含有硝酸,可能含有硝酸钡、硫酸中的一种; 实验四反应后的溶液中一定含有硫酸钾,可能含有氢氧化钾、硫酸中的一种,滤液a中所含离子分析如下图,首先确定溶液中一定有K+和NO3-,根据加稀硫酸无明显现象,可知滤液a中不含有Ba+,根据加过量的Ba(OH)2溶液后产生白色沉淀B,且白色沉淀B完全溶于稀硝酸,可知滤液a中一定有Mg2+,一定没有SO42-和OH-.综上所述滤液成分为一定有KNO3、Mg(NO3)2,可能有HNO3,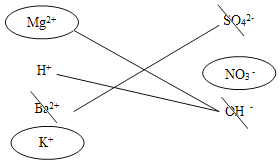
所以滤液a中所含溶质的所有可能情况是:KNO3、Mg(NO3)2和KNO3、Mg(NO3)2、HNO3;
②A、白色沉淀A中可能只含有BaSO4,故A错误;
B、白色沉淀B为氢氧化镁,所以可以用B检验CaC12溶液中是否含有盐酸,故B正确;
C、滤液b的成分为KNO3和Ba(OH)2,不能用来与适量的K2SO4溶液制备KNO3溶液,故C错误;
D、溶液C的成分为Mg(NO3)2和HNO3,与过量的NaOH溶液反应会产生白色沉淀,与过量的Na2CO3反应会产生气泡,故D正确。
故选:BD。
故答案为:
(1)Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;
(2)能;
(3)①KNO3、Mg(NO3)2和KNO3、Mg(NO3)2、HNO3;②BD。