题目内容
【题目】美国普渡大学研究出一种利用铝镓合金制备氢气的新工艺,流程如图所示:
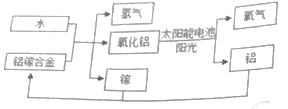
(1)氧化铝(Al2O3)制取铝的反应中铝元素的化合价______(填“升高”“降低”“不变”);
(2)此流程生成的氧化铝中氧元素来自于___________;
(3)上述过程中,涉及到的氧化物有_____________(填化学式)
(4)氧化铝可以借助太阳能电池重新变成氧气与金属铝,该反应的化学方程式为__________________,反应类型是__________________(填“化合反应”或“分解反应”)
【答案】降低; 水; H2O 、Al2O3; 2Al2O3![]() 4Al+3O2↑; 分解反应。
4Al+3O2↑; 分解反应。
【解析】
(1)化合物中元素的化合价代数和为零,氧元素显-2价,氧化铝(Al2O3)中铝元素的化合价为+3;单质中元素的化合价为零,所以所得金属铝中铝的化合价为零,反应中铝的化合价降低;
(2)据质量守恒定律可知反应前后元素的种类不变,由流程图可知反应前的物质有水和铝镓合金,反应后有氢气、镓、氧化铝,所以生成的氧化铝中氧元素来自于水;
(3)由两种元素组成,且其中一种元素是氧元素的化合物叫氧化物。化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写。上述过程中,涉及到的氧化物有H2O 、Al2O3;
(4)氧化铝可以借助太阳能电池重新变成氧气与金属铝,该反应的化学方程式为2Al2O3![]() 4Al+3O2↑;反应类型是由多种物质生成一种物质的化合反应。
4Al+3O2↑;反应类型是由多种物质生成一种物质的化合反应。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】学习了酸与碱的化学性质后,兴趣小组的同学利用实验室的一瓶氢氧化钠溶液进行如下探究。
探究Ⅰ(提出问题) 该氢氧化钠溶液是否已经变质?
氢氧化钠露置于空气中变质的反应方程式_________,___(填“是”或“不是”)复分解反应。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
方法1:取样,滴加足量的______, | 无气体产生 | 氢氧化钠溶液没有变质 |
方法2:取样,滴加氢氧化钙溶液 |
(实验结论)氢氧化钠溶液没有变质。
探究Ⅱ(提出问题) 中和反应过程中是否有能量变化?
(实验探究)
甲同学:取适量该氢氧化钠溶液,滴加1~2滴酚酞,在溶液中插入温度计,再逐滴加入稀盐酸,边滴加边搅拌,测得温度变化情况如图所示。
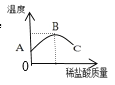
①写出该反应的化学方程式___________,实验中搅拌的目的是____________;
②从图像可知,中和反应是____过程;请解释BC段的成因__________。
乙同学:取少量氢氧化钠固体与稀盐酸反应进行实验,得出了同样的结论。小华同学认为,乙同学的结论不可信,你认为她的理由是___________。
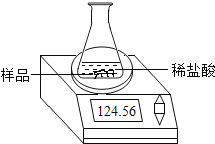
【题目】某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。实验装置如图所示:称取研细的2.50g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:
(1)反应生成二氧化碳的质量为_____。
(2)计算石灰石样品中CaCO3的质量分数_____。
(3)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能_____(填“偏大”、“偏小”或“准确”)。
反应前,整套装置+样品的质量/g | 共加入:稀盐 酸的质量/g | 反应后,整套装置+锥 形瓶中剩余物的质量/g |
104.60 | 20.00 | 123.72 |
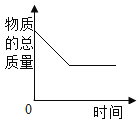
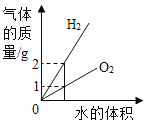
【题目】如图所示图像中,能正确反映对应变化关系的是
A | B | C | D |
|
|
|
|
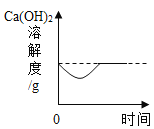
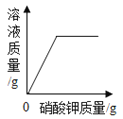
向饱和石灰水中加入一定量CaO | 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 | 一定质量的红磷在密闭容器内燃烧 | 电解水生成氢气和氧气质量 |
A. A B. B C. C D. D