题目内容
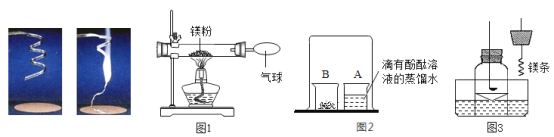
【题目】在测定质量守恒定律时,某同学设计了如图A、B两个实验,根据质量守恒定律回答下列问题:

(1)通过实验知道,实验A中反应前后质量总和相等,在该实验中气球变化的现象是________,实验B中测得反应前后质量减小了,质量减小的原因是_____,若要使该实验测得的质量相等,需要进行如何改进_______。
(2)以上两个实验中,满足质量守恒定律的是______。
(3)某学生在课外研究性学习活动课上用如图C所示的装置做实验,瓶内放了足量的稀硫酸,气球内放有一定量的镁粉,将它紧紧栓在瓶口上,放在托盘天平上称量,质量为W1,然后将气球内的镁粉全部倒入瓶内,反应的方程式为(Mg+H2SO4=== MgSO4+H2↑),观察到立即产生大量的气泡,气球逐渐胀大,充分反应后最终再次称量,质量为W2,结果W1>W2(装置不漏气)。反应后称得质量减小的原因是_______。
【答案】气球先变大后变小 因为生成的二氧化碳气体逸散到了空气中 让碳酸钠与稀盐酸在密闭的容器中反应。 A 生成的氢气使气球胀大,导致装置在空气中受到的浮力增大,使称得的质量减小
【解析】
(1)磷燃烧时放出大量热,使瓶内气体压强增大,气球胀大,燃烧结束后装置逐渐冷却至室温,由于氧气被反应掉,装置内气体减少,压强变小,气球变小,在该实验中气球变化的现象是气球先变大后变小,实验B中,生成二氧化碳气体,逸散到空气中,导致测得反应前后质量减小了,若要使该实验测得的质量相等,需要将装置密闭,使反应在密闭容器中进行;
(2)以上两个实验中,能正确测定反应前后物质的总质量不变的是A,满足质量守恒定律;
(3)用如图C所示的装置做实验,瓶内放了足量的稀硫酸,气球内放有一定量的镁粉,将它紧紧栓在瓶口上,放在托盘天平上称量,质量为W1,然后将气球内的镁粉全部倒入瓶内,反应的方程式为Mg+H2SO4=MgSO4+H2↑,观察到立即产生大量的气泡,气球逐渐胀大,充分反应后最终再次称量,质量为W2,结果W1>W2(装置不漏气)。反应后称得质量减小的原因是生成的氢气使气球胀大,导致装置在空气中受到的浮力增大,使称得的质量减小。