题目内容
【题目】水和溶液与生产、生活息息相关。
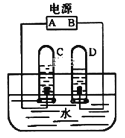
(1)电解水实验中,电源正极产生的气体是______,该反应的化学方程式为_____。
(2)净化水常用的方法有沉降、_________、吸附、蒸馏、消毒等。
(3)海水晒盐的原理是__________;
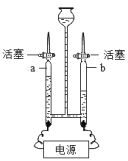
(4)配制200g溶质的质量分数为16%的氯化钠溶液,需氯化钠的质量分别为_________,实验操作如下图所示,正确的操作顺序为___________(填数字序号)。

【答案】氧气 2H2O 通电 2H2↑+ O2↑ 过滤 利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来 32g ③②⑤④①
【解析】
(1)电解水时,与电源正极相连的试管内产生的气体体积少,是氧气;水通电分解生成氢气和氧气,反应的化学方程式为:2H2O 通电 2H2↑+ O2↑;
(2)净化水常用的方法有沉降、过滤、吸附、蒸馏、消毒等。
(3)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,利用的是蒸发结晶的方法。
(4)溶质质量=溶液质量×溶质的质量分数,配制200g溶质的质量分数为16%的氯化钠溶液,需氯化钠的质量=200g×16%=32g。配制200g溶质的质量分数为16%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,称量所需的氯化钠、放入烧杯中、加水溶解,故正确的操作顺序为:③②⑤④①。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目