题目内容
某学生做了如图所示的实验 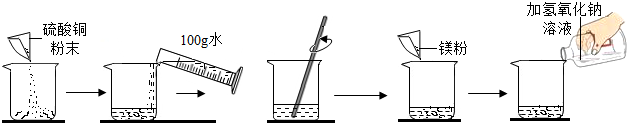
若第二次所加物质恰好完全反应(溶液损失忽略不计),请回答下列问题:
(1)写出第二次实验中发生反应的化学方程式 ;
(2)第一次实验后得到的固体物质的化学式为 ;
(3)根据已知条件列出求解第二次实验生成白色固体物质的质量(x)的比例式 ;
(4)实验中加入硫酸铜的质量(m)为 ;
(5)在第二次实验中,若将加入氢氧化钠溶液反应后的滤液蒸发掉6.2 g水,则所得溶液中溶质的质量分数为
(6)若用溶质质量分数为40%的氢氧化钠溶液配制实验中所需的氢氧化钠,则需要加水的质量为 .

第一次 | 第二次 | |
| 加入硫酸铜的质量 | m | m |
| 加入镁粉的质量 | 1.2g | 2.4g |
| 加入氢氧化钠溶液的质量 | 100g | 100g |
| 实验现象 | 紫色和蓝色固体及蓝色溶液 | 紫色、白色固体、无色溶液 |
(1)写出第二次实验中发生反应的化学方程式
(2)第一次实验后得到的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成白色固体物质的质量(x)的比例式
(4)实验中加入硫酸铜的质量(m)为
(5)在第二次实验中,若将加入氢氧化钠溶液反应后的滤液蒸发掉6.2 g水,则所得溶液中溶质的质量分数为
(6)若用溶质质量分数为40%的氢氧化钠溶液配制实验中所需的氢氧化钠,则需要加水的质量为
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由实验现象可知,反应有两个,根据化学方程式的要求正确书写;
(2)由实验现象可知,第一次实验后得到的固体物质有铜和氢氧化铜;
(3)由题意结合反应的关系式,根据镁元素的质量守恒解答;
(4)依据第二次所加物质恰好完全反应,根据镁的质量可以计算硫酸铜的质量;
(5)根据溶质质量分数的公式解答;
(6)根据加水稀释溶液溶质的质量不变解答;
(2)由实验现象可知,第一次实验后得到的固体物质有铜和氢氧化铜;
(3)由题意结合反应的关系式,根据镁元素的质量守恒解答;
(4)依据第二次所加物质恰好完全反应,根据镁的质量可以计算硫酸铜的质量;
(5)根据溶质质量分数的公式解答;
(6)根据加水稀释溶液溶质的质量不变解答;
解答:解:(1)由实验现象可知生成的紫色固体为铜,白色固体为氢氧化镁,反应有两个,即:Mg+CuSO4=Cu+MgSO4、MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
(2)由实验现象可知紫色固体为铜,蓝色固体为氢氧化铜,故第一次实验后得到的固体物质有铜和氢氧化铜;
(3)生成白色固体物质为氢氧化镁,
根据镁元素的质量守恒,可得关系式:
Mg~Mg(OH)2
24 58
2.4g x
=
;
(4)设,加入硫酸铜的质量为m,
Mg+CuSO4=Cu+MgSO4
24 160
2.4g m
=
m=16g;
(5)设,加入氢氧化钠溶液中溶质的质量为y
Mg~2NaOH
24 80
2.4g y
=
y=8g;
加入氢氧化钠溶液反应后的滤液蒸发掉6.2 g水,则所得溶液中溶质的质量分数为:
×100%=8.5%
(6)设需要加水的质量为z
(100g-z)×40%=8g
z=80g
答案:(1)Mg+CuSO4=Cu+MgSO4、MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
(2)Cu,Cu(OH)2
(3)
=
;
(4)16g
(5)8.5%
(6)80g
(2)由实验现象可知紫色固体为铜,蓝色固体为氢氧化铜,故第一次实验后得到的固体物质有铜和氢氧化铜;
(3)生成白色固体物质为氢氧化镁,
根据镁元素的质量守恒,可得关系式:
Mg~Mg(OH)2
24 58
2.4g x
| 24 |
| 2.4g |
| 58 |
| x |
(4)设,加入硫酸铜的质量为m,
Mg+CuSO4=Cu+MgSO4
24 160
2.4g m
| 24 |
| 2.4g |
| 160 |
| m |
m=16g;
(5)设,加入氢氧化钠溶液中溶质的质量为y
Mg~2NaOH
24 80
2.4g y
| 24 |
| 2.4g |
| 80 |
| y |
y=8g;
加入氢氧化钠溶液反应后的滤液蒸发掉6.2 g水,则所得溶液中溶质的质量分数为:
| 8g |
| 100g-6.2g |
(6)设需要加水的质量为z
(100g-z)×40%=8g
z=80g
答案:(1)Mg+CuSO4=Cu+MgSO4、MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
(2)Cu,Cu(OH)2
(3)
| 24 |
| 2.4g |
| 58 |
| x |
(4)16g
(5)8.5%
(6)80g
点评:本题难度很大,即考查了化学方程式的书写,有考查了根据化学方程式的计算、反应后溶液中溶质质量分数的计算、稀释问题等,需逐步分析细心解答.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
化学实验既要操作规范,更要保障安全.下列实验基本操作符合这一要求的是( )
A、 给液体加热 |
B、 取用固体粉末 |
C、 闻气体气味 |
D、 滴加液体 |
 如图是某化肥的标签,请计算:
如图是某化肥的标签,请计算: