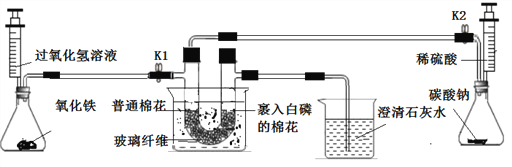
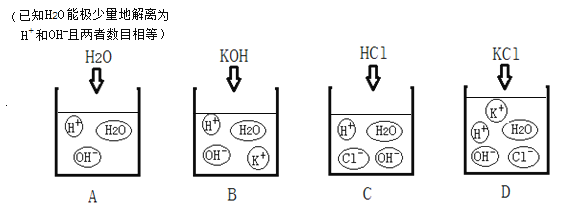
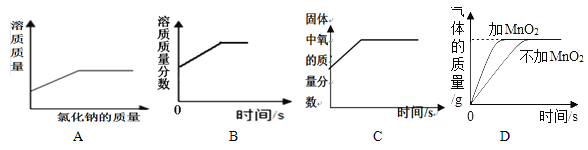
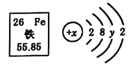
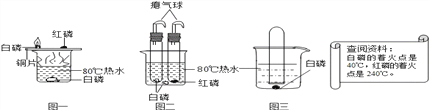
题目内容
【题目】A-G是初中化学常见的物质,由氢、碳、氧、钙、铁中的一种或几种组成。已知A是一种红色固体,C是常见的金属,D有助燃性,A、B、E、F都是氧化物,G是含钙的化合物,物质之间的相互反应及转化关系如图所示,图中“→”表示转化关系,“ — ”表示能相互反应。 (部分反应物、生成物或反应条件已略去)。
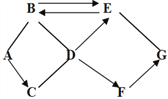
请回答下列问题
(1)分别写出物质E、G的化学式: _______ ________.
(2)写出C、D发生剧烈氧化时的现象 __________________
(3)写出A-B发生反应的化学方程式_________________________________
(4) 物质F可以是__________,也可以是 __________.
【答案】 CO2 Ca(OH)2 剧烈燃烧火星四射,生成黑色固体,同时放出大量的热 3CO+ Fe2O3 高温 2Fe + 3CO2 CaO H2O
【解析】本题是框图型推断题。在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
A-G是初中化学常见的物质,由氢、碳、氧、钙、铁五种元素中的一种或几种组成,A是一种红色固体, A是氧化铁,D有助燃性, D是氧气,氧化铁能转化为C,C是常见的金属,C是铁,氧化铁能与B反应,B是氧化物,则B是CO,E是氧化物且能与CO相互转化,则E是CO2,G能与CO2反应且G是含钙的化合物,则G是氢氧化钙,F能转化为氢氧化钙,且F为氧化物,则F是水或氧化钙,代入框图,推理合理。因此:
(1)物质E、G分别是二氧化碳、氢氧化钙,化学式分别是:CO2、Ca(OH)2;
(2) C、D发生剧烈氧化时是铁有氧气燃烧,反应的现象是剧烈燃烧火星四射,生成黑色固体,同时放出大量的热;
(3) A-B发生反应是氧化铁和一氧化碳在高温下反应生成铁和二氧化碳,化学方程式是3CO+ Fe2O3 高温 2Fe + 3CO2 ;
(4) 根据分析,物质F可以是CaO,也可以是H2O。

【题目】为测定铜锌合金中锌的质量分数,进行了以下实验;取40g铜锌合金放入烧杯中,称得烧杯及所盛铜锌合金的总质量为140g,再把120g盐酸平均分成四份依次加入烧杯中,每次充分反应后进行称量,实验数据如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
烧杯及所盛物质的总质量/g | 169.7 | 199.4 | 229.2 | 259.2 |
请你据此分析计算:
(1)第一次实验生成氢气的质量是 ________ g.
(2)利用第一次实验的数据,计算30g盐酸中溶质的质量分数________ (写出计算过程,精确到0.1%)
(3)实验最终结束后,同学们求出了合金中锌的质量分数=__________.
(4)下图表示所加盐酸的质量与反应后所得溶液质量的关系曲线,请写出A点(X=______ ,Y=______)的坐标。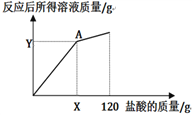
【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
【提出问题】![]() 白色沉淀A是什么?
白色沉淀A是什么?
(2)无色滤液B中的溶质有哪些?
【查阅资料】腌制皮蛋的原料配方是少量NaCl、CaO和过量![]() 的固体混合物。
的固体混合物。
【理论推理】![]() 白色沉淀A是
白色沉淀A是![]() ,请写出生成该沉淀的化学方程式______。
,请写出生成该沉淀的化学方程式______。
![]() 滤液B中含有
滤液B中含有![]() 、NaOH、NaCl三种溶质。
、NaOH、NaCl三种溶质。
【实验验证】为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
I | 取少量滤液B于试管中,加入过量的 | ______ | 滤液B中含有 |
II | 取少量步骤I中所得滤液于试管中,加入酚酞溶液 | ______ | |
III | 另取少量步骤I中所得滤液于试管中,先加入足量的稀硝酸,再加入 ______ 溶液 | 产生白色沉淀 |
【拓展提升】
![]() 向步骤I中加入过量
向步骤I中加入过量![]() 溶液的目的是______。
溶液的目的是______。
![]() 小妮同学认为若将步骤I中的
小妮同学认为若将步骤I中的![]() 溶液换为
溶液换为![]() 溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______
溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______![]() 填“合理”或“不合理”
填“合理”或“不合理”![]() 。
。
![]() 小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的
小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的![]() 溶液,也能得出滤液B的溶质中含有
溶液,也能得出滤液B的溶质中含有![]() 和NaOH的结论,你是否同意他的观点并说明理由______。
和NaOH的结论,你是否同意他的观点并说明理由______。