题目内容
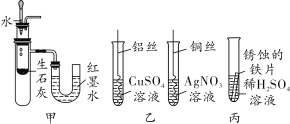
【题目】根据如图所示实验回答问题:
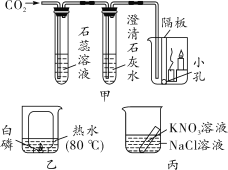
(1)甲为二氧化碳性质实验,实验中将二氧化碳通入紫色石蕊溶液,石蕊溶液变红,说明______;二氧化碳通入澄清石灰水,观察到的现象是____;二氧化碳通入烧杯中,观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的物理性质是____。
(2)乙实验将收集满氧气的小集气瓶倒扣入盛有白磷的大烧杯中,扣入小集气瓶前白磷不燃烧,扣入后白磷燃烧,由此说明________。
(3)丙实验不能用于验证质量守恒定律,原因是_____。
【答案】二氧化碳与水反应生成了酸 澄清石灰水变浑浊 二氧化碳的密度比空气大 可燃物燃烧需要与氧气接触 硝酸钾和氯化钠不能发生化学反应
【解析】
(1)甲实验中二氧化碳通入紫色石蕊溶液中,先与水反应生成碳酸,碳酸能使紫色石蕊溶液变红。二氧化碳通入澄清石灰水中,发生的反应是二氧化碳与氢氧化钙溶液反应,生成碳酸钙沉淀和水,观察到的现象是澄清石灰水变浑浊。将二氧化碳通入大烧杯后,观察到蜡烛由低到高依次熄灭,说明二氧化碳具有密度比空气大的物理性质和不燃烧也不支持燃烧的化学性质。(2)乙实验大烧杯热水中的白磷达到了着火点而没有燃烧,是因为没有与氧气接触,将收集满氧气的小集气瓶倒扣入大烧杯中,白磷与氧气接触而燃烧,这一对比,说明可燃物燃烧需要与氧气接触 。(3)丙实验中硝酸钾与氯化钠不能发生化学反应,而质量守恒定律只适用于化学反应,所以该实验不能用于验证质量守恒定律。

【题目】某同学进行下图两个实验。
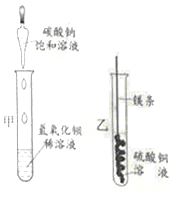
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。
【题目】碱石灰是实验室常用的干燥剂,新制的碱石灰是CaO和NaOH的混合物。
(提出问题)敞口放置一段时间的碱石灰样品中的成分是什么?
(问题猜想)碱石灰样品中可能含有CaO、NaOH、CaCO3、Na2CO3和________等五种物质。
(查阅资料)BaCl2溶液显中性。
(实验探究)实验小组进行了以下实验探究。
实验步骤 | 过程或现象 | 结论 |
Ⅰ. 取少量样品于试管中,加入适量水 | 试管壁发热 | 样品中CaO、NaOH至少含一种 |
Ⅱ. 向上述试管中继续加入足量的水,振荡、静置并过滤 | 得到溶液A和固体B | 样品中一定含有CaCO3 |
Ⅲ. 向溶液A中加入过量的BaCl2溶液,振荡、静置并过滤 | 得到溶液C和固体D | 溶液A中含有CO |
Ⅳ. 向溶液C中滴加无色酚酞溶液 | 溶液变红色 | C溶液显碱性 |
(思考分析)(1)有同学认为步骤Ⅱ的结论不准确,原因是______________。
(2)判断溶液A中加入的BaCl2溶液过量的方法是_________________。
(3)写出步骤Ⅲ中相关反应的化学方程式_______________。
(4)溶液C中所含阳离子的符号________。
(实验结论)通过以上实验探究,能确定该碱石灰样品中肯定含有的成分是________________。