题目内容
(7分)铁、铜等金属在我们的生活和工业生产中应用很广。
(1)制造汽车所用的钢材是 (填“铁”或“铜”)的合金,这种金属在活动性顺序中排在(H)的 面;为保护汽车的金属外壳,表面通常喷一层油漆,其主要作用是隔 绝 ,防止金属锈蚀。

(2)某工厂利用废铁丝、硫酸铜废液(含硫酸亚铁)和废铜粉制备硫酸铜晶体。具体过程如下:
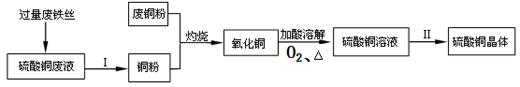
①废铁丝投入到硫酸铜废液里发生反应的化学方程式为 ,废铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是 。
②过量废铁丝与硫酸铜废液充分反应后,为了得到纯净的铜粉,Ⅰ的主要步骤是 。
③在“氧化铜”(含少量铜)转化为硫酸铜溶液的过程中,以下化学反应方程式与该过程有关的是 。
(1)制造汽车所用的钢材是 (填“铁”或“铜”)的合金,这种金属在活动性顺序中排在(H)的 面;为保护汽车的金属外壳,表面通常喷一层油漆,其主要作用是隔 绝 ,防止金属锈蚀。

(2)某工厂利用废铁丝、硫酸铜废液(含硫酸亚铁)和废铜粉制备硫酸铜晶体。具体过程如下:

①废铁丝投入到硫酸铜废液里发生反应的化学方程式为 ,废铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是 。
②过量废铁丝与硫酸铜废液充分反应后,为了得到纯净的铜粉,Ⅰ的主要步骤是 。
③在“氧化铜”(含少量铜)转化为硫酸铜溶液的过程中,以下化学反应方程式与该过程有关的是 。
A.2Cu+ O2 2CuO 2CuO |
B.2Cu+O2+2H2SO4 2CuSO4+2H2O 2CuSO4+2H2O |
C.Cu + H2SO4  CuSO4 + H2 ↑ CuSO4 + H2 ↑ |
D.CuO + H2SO4  CuSO4 + H2O CuSO4 + H2O |
(1)铁(或Fe) 前 空气(或氧气)和水
(2)① Fe + CuSO4= FeSO4 + Cu 除去铁丝表层的氧化物(或除铁锈)
② 加足量的稀硫酸(或加硫酸至无气泡产生)、过滤
③ ABD
(2)① Fe + CuSO4= FeSO4 + Cu 除去铁丝表层的氧化物(或除铁锈)
② 加足量的稀硫酸(或加硫酸至无气泡产生)、过滤
③ ABD
试题分析:根据金属活动性顺序的意义进行分析,在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,金属氧化物能与酸反应生成盐和水。
(1)钢材属于铁的合金,铁在金属活动性顺序中位于氢的前面,铁在有水和氧气并存时易生锈,所以在其表面喷油漆来隔绝空气(或氧气)和水,防止金属锈蚀。
(2)①废铁丝表面有锈,需将铁锈用酸除掉;铁在铜的前面,能将硫酸铜中的铜置换出来,故反应的化学方程式为Fe + CuSO4= FeSO4 + Cu。
②铁在氢的前面能与酸反应,而铜位于氢后不与酸反应,故多余的铁可以用酸反应除去,所以Ⅰ的主要步骤是:加足量的稀硫酸(或加硫酸至无气泡产生)、过滤。
③根据题干提供的过程图可知,在“氧化铜”(含少量铜)转化为硫酸铜溶液的过程中,反应的条件是:加酸、加热和通氧气,在此条件下,铜能与氧气反应生成氧化铜,铜也能与氧气和酸共同作用生成铜盐,还有氧化铜能与酸反应生成铜盐和水,故选ABD。
点评:解答本题的关键,是要理解和熟练掌握金属活动性顺序及其应用,结合具体的问题情境,依据金属活动性顺序及其意义进行分析解答。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目