题目内容
有一包粉末可能含有CaCO3、Na2CO3、Na2SO4、CuSO4、NaNO3中的一种或者几种,某学生为确定其组成,作如下实验,请根据实验现象进行推断把相应物质的化学式(分子式)填在表中的空格内.
| 实验内容和步骤 | 实验现象 | 结论 |
| (1)在试管中加入少量粉末,注入足量的蒸馏水充分振荡 | 溶液无色透明 | 原粉末中肯定不含有的物质是: |
| (2)取少量上述溶液滴入盐酸 | 有气泡产生 | 肯定有的物质是: |
| (3)另取(1)中少量溶液滴入氯化钡溶液 | 有白色沉淀产生 | 原粉末中肯定还有的物质是: 可能有的物质是: |
| (4)在(3)中滴加稀硝酸 | 沉淀部分溶解,并有气泡产生 |
考点:物质的鉴别、推断,盐的化学性质
专题:混合物组成的推断题
分析:根据碳酸钙难溶于水,会与酸反应,碳酸钠和盐酸反应会生成二氧化碳,硫酸铜在溶液中显蓝色,碳酸钠、硫酸钠和氯化钡会生成碳酸钡沉淀、硫酸钡沉淀,碳酸钡沉淀溶于酸,硫酸钡沉淀不溶于酸等知识进行分析.
解答:解:碳酸钙难溶于水,会与酸反应,碳酸钠和盐酸反应会生成二氧化碳,硫酸铜在溶液中显蓝色,碳酸钠、硫酸钠和氯化钡会生成碳酸钡沉淀、硫酸钡沉淀,碳酸钡沉淀溶于酸,硫酸钡沉淀不溶于酸.
(1)取粉末溶于水,得到无色透明溶液,硫酸铜溶于水显蓝色,碳酸钙难溶于水,说明粉末中一定不含溶于水呈蓝色的硫酸铜和不溶于水的碳酸钙;
(2)取少量上述溶液滴入盐酸,在所剩余的碳酸钠、硫酸钠、硝酸钠三种物质中,碳酸钠能与稀盐酸反应放出二氧化碳气体,所以粉末中一定含有碳酸钠;
(3)在所剩余的碳酸钠、硫酸钠、硝酸钠三种物质中,碳酸钠、硫酸钠均能与氯化钡分别生成碳酸钡沉淀和硫酸钡沉淀,因此,滴加氯化钡溶液出现白色沉淀时,说明粉末中还有有碳酸钠和硫酸钠中的一种或两种;
(4)在(3)中滴加稀硝酸,沉淀部分溶解,并有气泡产生,说明沉淀中有硫酸钡和碳酸钡,则原粉末中肯定还有的物质是 Na2SO4,因为硝酸钠存在与否对实验现象没有影响,所以可能有的物质是 NaNO3,所以
故答案为:
(1)取粉末溶于水,得到无色透明溶液,硫酸铜溶于水显蓝色,碳酸钙难溶于水,说明粉末中一定不含溶于水呈蓝色的硫酸铜和不溶于水的碳酸钙;
(2)取少量上述溶液滴入盐酸,在所剩余的碳酸钠、硫酸钠、硝酸钠三种物质中,碳酸钠能与稀盐酸反应放出二氧化碳气体,所以粉末中一定含有碳酸钠;
(3)在所剩余的碳酸钠、硫酸钠、硝酸钠三种物质中,碳酸钠、硫酸钠均能与氯化钡分别生成碳酸钡沉淀和硫酸钡沉淀,因此,滴加氯化钡溶液出现白色沉淀时,说明粉末中还有有碳酸钠和硫酸钠中的一种或两种;
(4)在(3)中滴加稀硝酸,沉淀部分溶解,并有气泡产生,说明沉淀中有硫酸钡和碳酸钡,则原粉末中肯定还有的物质是 Na2SO4,因为硝酸钠存在与否对实验现象没有影响,所以可能有的物质是 NaNO3,所以
| 实验内容和步骤 | 实验现象 | 结论 |
| CaCO3、CuSO4 | ||
| Na2CO3 | ||
| Na2SO4 NaNO3 | ||
| 实验内容和步骤 | 实验现象 | 结论 |
| CaCO3、CuSO4 | ||
| Na2CO3 | ||
| Na2SO4 NaNO3 | ||
点评:根据物质的性质或变化规律,结合实验探究中每步实验所出现的现象,对混合物的可能组成进行分析、判断,最终形成结论.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列实验中,仪器和用品的选择不合理的是( )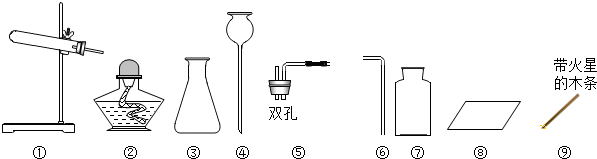

| A、收集CO2气体-⑥⑦⑧ |
| B、检验一瓶气体是否为O2-⑦⑧⑨ |
| C、用H2O2溶液和MnO2制O2-①② |
| D、用大理石和稀盐酸制CO2-③④⑤ |
燃烧是生活中一种常见现象,下列有关燃烧或灭火的说法中错误的是( )
| A、碳、硫在氧气中燃烧比在空气中燃烧剧烈 |
| B、用水可以灭火,是因为降低了可燃物的着火点 |
| C、锅里的油着火时可用锅盖盖灭,是因为隔绝了氧气 |
| D、山林中的小道可以起到防火隔离带的作用 |