题目内容
将一黄铜样品粉末(含锌、铜)7.0克,投入49.0克未知浓度的硫酸溶液中,恰好完全反应,生成0.2克氢气.试求:
(1)黄铜中锌的百分含量为多少?
(2)生成硫酸锌多少克?
(3)生成所硫酸锌溶液质量百分比浓度为多少?
(1)黄铜中锌的百分含量为多少?
(2)生成硫酸锌多少克?
(3)生成所硫酸锌溶液质量百分比浓度为多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:根据氢气的质量可以计算锌的质量和生成硫酸锌的质量,进一步可以计算黄铜中锌的百分含量和生成所硫酸锌溶液质量百分比浓度.
解答:解:(1)设锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 161 2
x y 0.2g
=
,
x=6.5g,y=16.1g,
黄铜中锌的百分含量为:
×100%=7.1%,
答:黄铜中锌的百分含量为7.1%.
(2)答:生成硫酸锌的质量是16.1g.
(3)生成所硫酸锌溶液质量百分比浓度为:
×100%=29.1%,
答:生成所硫酸锌溶液质量百分比浓度为29.1%.
Zn+H2SO4═ZnSO4+H2↑,
65 161 2
x y 0.2g
| 65 |
| x |
| 161 |
| y |
| 2 |
| 0.2g |
x=6.5g,y=16.1g,
黄铜中锌的百分含量为:
| 7.0g-6.5g |
| 7.0g |
答:黄铜中锌的百分含量为7.1%.
(2)答:生成硫酸锌的质量是16.1g.
(3)生成所硫酸锌溶液质量百分比浓度为:
| 16.1g |
| 6.5g+49.0g-0.2g |
答:生成所硫酸锌溶液质量百分比浓度为29.1%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
区别下列各组物质方法错误的是( )
| 选项 | 物质 | 实验方法及现象 |
| A | 铁和四氧化三铁 | 用磁铁吸引,看能否被吸引 |
| B | 食盐和纯碱 | 滴加食醋,看是否产生气泡 |
| C | 碳酸氢铵和硫酸铵 | 滴加稀盐酸,看是否产生气泡 |
| D | 过氧化氢和蒸馏水 | 加入二氧化锰,看是否产生气泡 |
| A、A | B、B | C、C | D、D |
空气污染物对人类健康及生态环境都有危害,下列各组物质中全部都属于空气污染物的一组是( )
| A、氟氯烃、一氧化碳、氮氧化物 |
| B、氮气、一氧化碳、二氧化硫 |
| C、氮气、氧气、水蒸气 |
| D、水蒸气、二氧化硫、氮氧化物 |
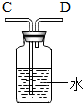
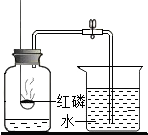 如图为测定空气中氧气含量的实验装置图.
如图为测定空气中氧气含量的实验装置图.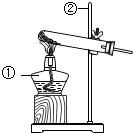
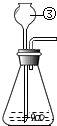
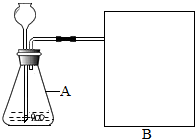 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程: