题目内容
在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止.在上述实验中,试回答:
(1)为什么要滴入几滴酚酞溶液?
(2)为什么要用滴管慢慢滴加稀盐酸?
(3)为什么要不断搅拌溶液?
(4)在该反应中,减少了什么离子(用符号表示)?
(1)为什么要滴入几滴酚酞溶液?
(2)为什么要用滴管慢慢滴加稀盐酸?
(3)为什么要不断搅拌溶液?
(4)在该反应中,减少了什么离子(用符号表示)?
考点:中和反应及其应用
专题:常见的酸 酸的通性
分析:(1)氢氧化钠溶液显碱性,能使酚酞试液变红色,当氢氧化钠和稀盐酸恰好完全反应时,酚酞试液变成无色;
(2)稀盐酸和氢氧化钠反应生成氯化钠和水;
(3)搅拌能使稀盐酸和氢氧化钠混合均匀;
(4)氢氧化钠和稀盐酸反应过程中,氢离子和氢氧根离子结合生成水.
(2)稀盐酸和氢氧化钠反应生成氯化钠和水;
(3)搅拌能使稀盐酸和氢氧化钠混合均匀;
(4)氢氧化钠和稀盐酸反应过程中,氢离子和氢氧根离子结合生成水.
解答:解:(1)滴入几滴酚酞溶液时,氢氧化钠溶液变红色,当氢氧化钠和稀盐酸恰好完全反应时,红色消失,因此滴入几滴酚酞溶液能够指示反应终点.
(2)用滴管慢慢滴加稀盐酸时,能够控制稀盐酸的加入量,便于控制反应的进行.
(3)不断搅拌溶液时,能使稀盐酸和氢氧化钠均匀地反应,能够防止稀盐酸过量.
(4)在该反应中,氢离子和氢氧根离子结合生成水,因此氢离子和氢氧根离子不断减少,氢离子和氢氧根离子的符号是H+、OH-.
(2)用滴管慢慢滴加稀盐酸时,能够控制稀盐酸的加入量,便于控制反应的进行.
(3)不断搅拌溶液时,能使稀盐酸和氢氧化钠均匀地反应,能够防止稀盐酸过量.
(4)在该反应中,氢离子和氢氧根离子结合生成水,因此氢离子和氢氧根离子不断减少,氢离子和氢氧根离子的符号是H+、OH-.
点评:实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
相关题目
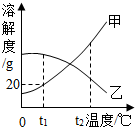 甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )| A、甲物质的溶解度为20g |
| B、t1℃时,30g甲加入到50g水中可得80g溶液 |
| C、t2℃时,乙物质的饱和溶液升温变成不饱和溶液 |
| D、t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲<乙 |
 电解水实验装置如图:
电解水实验装置如图: