��Ŀ����
����Ŀ��A��EΪ����ϡ���ᡢ����ͭ��Һ������ʯ��ˮ��̼������Һ�е�һ�֣�����E����ɫ��Һ��BΪ���塣����֮��Ĺ�ϵ��ͼ��ʾ����һ����ʾ�����������ܷ�����Ӧ�����漰��Ӧ��Ϊ���г����Ļ�ѧ��Ӧ����
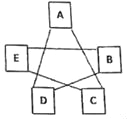
��1��D�Ļ�ѧʽΪ_____��
��2��E��C��Ӧ�Ļ�ѧ����ʽ_____��
��3��ͼ�����ڸ��ֽⷴӦ��������������ķ�Ӧ�Ļ�ѧ����ʽΪ_____��
��4�����A��C��D��E�����䣬�����ʼ�Ĺ�ϵ���䣬B��������_____��
A Ag B KOH C BaCl2 D Mg��OH��2 E Fe2O3
���𰸡�H2SO4 CuSO4+Ca��OH��2��Cu��OH��2��+CaSO4 Na2CO3+H2SO4��Na2SO4+H2O+CO2�� B
��������
�⣺E����ɫ��Һ��BΪ���壬��E������ͭ��B������D�ܹ�������Ӧ����D�����ᣬA�ܹ��������C��Ӧ��C�ܹ�������ͭ��A��Ӧ����A������̼���ƣ�C������ʯ��ˮ�������ͼ�ƶϺ�����
��1��D�����ᣬ��ѧʽΪH2SO4��
��2��E��C������ͭ���������Ƶķ�Ӧ���䷴Ӧ�Ļ�ѧ����ʽΪ��CuSO4+Ca��OH��2��Cu��OH��2��+CaSO4��
��3��ͼ�����ڸ��ֽⷴӦ��������������ķ�Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+H2SO4��Na2SO4+H2O+CO2����
��4�����A��C��D��E�����䣬�����ʼ�Ĺ�ϵ���䣻
A�������������������ͭ��Ӧ���ʲ���ѡ��
B���������ؼȿ��Ժ����ᷴӦ�ֿ��Ժ�����ͭ��Ӧ����ѡ��
C��������þ���Ժ����ᷴӦ��������������ͭ��Ӧ���ʲ���ѡ��
D�����������ܺ�����ͭ��Ӧ���ܹ������ᷴӦ���ʲ���ѡ��
�ʴ�Ϊ����1��H2SO4����2��CuSO4+Ca��OH��2��Cu��OH��2��+CaSO4����3��Na2CO3+H2SO4��Na2SO4+H2O+CO2������4��B��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ijɽ��ʢ��ʯ��ʯ�����к��е�����Ϊ�������裨������ˮ�����������Էֽ�������������S��ѧ������ѧ�о���ѧϰС���ͬѧΪ�˲ⶨij��ɽʯ��ʯ�Ĵ��ȣ�ȡ2.0g�ÿ�ɽʯ��ʯ��Ʒ����20.0g����ƽ���ֳ�4�ݣ���4���뵽��Ʒ�У���ַ�Ӧ��ⶨʣ���������������ݼ���������
���� | 1 | 2 | 3 | 4 |
������������/g | 5.0 | 5.0 | 5.0 | 5.0 |
ʣ���������/g | 1.3 | 0.6 | 0.2 | 0.2 |
��1��2.0gʯ��ʯ��Ʒ�����ʵ�������
��2��ʯ��ʯ��Ʒ��̼��Ƶ�����������
��3����������������ʵ����������Ƕ��٣�
����Ŀ�����ݵ���ʯ��ʯ��Դ�ḻ��ij��ѧ��ȤС���ȡ4.0gʯ��ʯ��Ʒ����40gϡ�����4�μ�����Ʒ��(�������ʲ���ӦҲ���ܽ�)����ʵ���������£�
ϡ��������� | ʣ���������� |
��һ�μ���10g | 3.0g |
�ڶ��μ���10g | 2.0g |
�������10g | 1.0g |
���Ĵμ���10g | 0.6g |
����㣺
(1)4.0gʯ��ʯ��Ʒ��̼��Ƶ�������____g��
(2)10gϡ��������_____g̼���������ȫ��Ӧ��
(3)��ϡ�����������������Ϊ_________(д��������̣������ȷ��0.1%)
����Ŀ����������--����������BaCl2������ж�����H2S������NaOH����H2S���壬ͬʱ����ȡNa2S�ķ������д�������Ӧ����ʽΪ��H2S+2NaOH=Na2S+2H2O������ΪH2S���չ��յĸ��������ɱ���
��Ŀ | ���ۣ�Ԫ/�֣� |
NaOH | 2500 |
Na2S | 5000 |
�������ã��Դ���1��H2S�ƣ� | 1114 |
��1����ij������ÿ����ȥ10��NaOH�������ϴ������ٶ�H2S��
��2����ҵ����β���迼�Ǿ���Ч������Ч�棬����������ϣ�ͨ��������������Ӿ���Ч�濼�����ִ���H2S�ķ�����ӯ�����ǿ���
����Ŀ����Һ�����ǵ���������������ء�
��1�������KNO3�ڲ�ͬ�¶�ʱ���ܽ�ȣ��ش����⡣
�¶�/�� | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
�ܽ��/g | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
90��ʱ����һ��������KNO3��Һ��ͼ1ʾ���в�����

90��ʱ��KNO3��Һ��______����������������������������Һ��ͼ��n����ֵΪ______��
��2���������ͼ2�мס��ҡ������ֹ�����ܽ�����ش����⡣
T3��ʱ���ڸ����мס��ҡ���30�˹���������ձ��У��ֱ���50��ˮ����ֽ�����γɱ�����Һ����______���¶Ƚ�����T2��ʱ����������Һ�����ʵ����������ɴ�С��˳��Ϊ______��
T3��ʱ100��ˮ�м���95�˼Ĺ��壬����ȫ���ܽ⣬һ��ʱ������в��ּĹ�����������ȫ���ܽ�����ԭ������ǣ�______��


