题目内容
【题目】某同学配制50g9%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
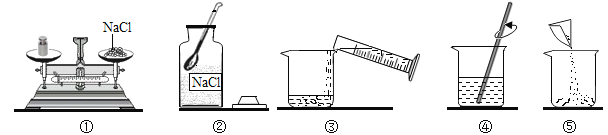
(1)配制溶液的正确操作顺序为__________(填序号),其中操作错误的是__________(填序号)
(2)图②中盛放氯化钠固体的仪器名称是__________,需称取氯化钠_________g。
(3)量水时选用的量筒的量程最合适的是______(填字母),读数时视线要与量筒内_______保持水平。
A.10mL B.25mL C.50mL D.100mL
【答案】②①⑤③④①广口瓶4.5C凹液面的最低处
【解析】
根据所学知识和题中信息知,(1)配制溶液的正确操作顺序为②取药品①称量⑤倒入烧杯③倒入水④搅拌溶解。其中操作错误的是①,药品不应直接放在托盘上,以免腐蚀托盘。(2)图②中盛放氯化钠固体的仪器名称是广口瓶。需称取氧化钠是50g×9%=4.5g。(3)50g-4.5g=45.5g,根据就近原则,量水时选用的量筒的量程最合适的是50mL。故选C。读数时视线要与量筒内凹液面的最低处保持水平。
点睛∶药品不应直接放在天平托盘上,量筒量程的选择应根据就近原则,读数应平视。

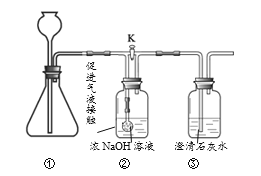
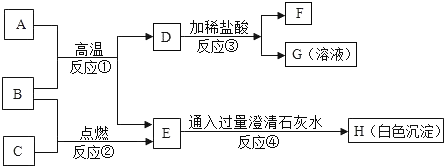
【题目】某研究性学习小组在”利用燃碳法测定空气中氧气的体积分数”的实验时(如图),发现个现象:用氢氧化钠溶液吸收生成的二氧化碳后,进入氧气瓶中水的体积分数仍然小于1/5。

(提出问题)是什么原因导致测量不准确呢?
(猜想与假设)他们分别作了如下猜想:
甲同学:可能是木炭取的量过少;
乙同学:可能是木炭燃烧没有消耗完集气瓶中的氧气。
(探究一)
小组同学发现实验结束后,燃烧匙中还有残留的黑色固体,都认为_____同学的猜想不合理。
(查阅资料)木炭、棉花和蜡烛在密闭容器内燃烧停止后,残留氧气的体积分数分别高达14.0%,8.0%和16.0%
(进行实验)乙同学又利用上述装置设计了如下实验,请你填写下表:
实验步骤 | 实验现象 | 实验讨论 |
①将足量木炭点燃,迅速插入集气瓶中 | _____ | 木炭燃烧没有消耗完集气瓶中的氧气 |
②待装置冷却后,将燃着的________(填“棉花”或蜡烛)再伸入集气瓶中 | _____ |
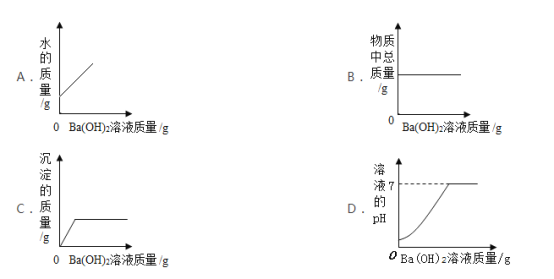
(实验反思)小明从木炭燃烧产物的角度猜想还可能是生成了_____导致测量结果小于1/5;于是用注射器抽取集气瓶内的气体做了图2所示的实验,当观察到澄清石灰水变浑浊,可证明小明的猜想成立,则该现象涉及的化学方程式为_____,该实验中没有观察到氧化铜粉末变红的原因可能是_____
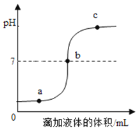
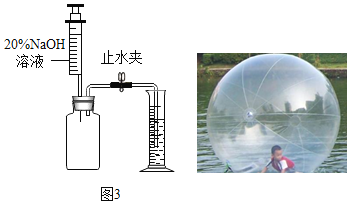
(拓展迁移)若要测量“水上步行球”内空气中二氧化碳的体积含量,利用图3装置,若集气瓶中收集的“水上步行球”内空气样品的体积为500mL,加入足量的氢氧化钠溶液充分振荡后,打开止水夹后量筒中的水流入集气瓶中5mL,则球内空气中CO2的体积含量是_____
【题目】加热碳酸氢铵时闻到了刺激性气味,引起了同学们对氨气的兴趣,决定对其进行探究。
(一)探究性质与变化
(实验方案)如图所示

(实验现象)
(1)实验一中的现象是_____。
(2)实验二中先滴入浓氨水,一段时间后,再滴入浓盐酸。滴入浓盐酸后观察到的现象是:①集气瓶中从下至上出现白烟,②_____(写一点)。
(实验结论)
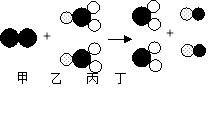
(3)微观上,说明微粒具有的性质是_____。宏观上,从物质的性质或变化的角度分析,你得出的结论是_____(写一点)。
(反思与评价)
(4)实验二避免了实验一的不足,改进后的优点有_____(写一点)。
(二)验证氨气中氮、氢两种元素的质量比
(查阅资料)
(5)氨气在加热条件下能与氧化铜反应:2NH3+3CuO![]() 3X+N2+3H2O,X的化学式是_____。
3X+N2+3H2O,X的化学式是_____。
(设计方案)如图所示:(假定氮气被完全吸收)
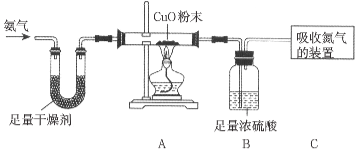
(数据处理与误差分析)
充分反应后,测得A、B、C三个装置在反应前后的质量变化如下表所示
装置 | A | B | C |
数据 | 减少了4.8g | 增加了6.0g | 增加了2.8g |
(6)甲同学利用A、B、C三组装置所提供的数据,乙同学利用B、C两组装置所提供的数据,计算出的氮、氢元素的质量比都与理论值明显不符,分析产生误差的原因是_____。
(7)若用A、C两组装置所提供的数据计算,与理论值是否相符?写出简单的计算过程证明你的结论_____。
(三)探究用途与制法
(8)在一定条件下,可用氮气和氢气制得氨气。工业上常用氨气生产氮肥(NH4)2SO4,施肥时,要避免与之混用的是_____(填序号)。
A.硝酸钾 B.草木灰(主要成分是K2CO3)
C.熟石灰 D.氯化钾
(9)工业上生产的(NH4)2SO4中常常混有少量KCl,检验其是否含有KCl的操作方法是_____。