题目内容
14、质量守恒定律的定量研究对化学科学发展具有重大意义.
(1)我国从今年5月1日起,酒驾入刑.“酒精检测仪”可检查司机是否酒后驾车,其反应原理为C2H5OH+4CrO3+6H2SO4═2Cr2(SO4)3+2CO2↑+9X,反应中红色的CrO3转变为绿色的Cr2(SO4)3,其中X的化学式为
(2)下图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子:
 由“
由“ ”聚集成的物质
”聚集成的物质
(3)已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),m1
(1)我国从今年5月1日起,酒驾入刑.“酒精检测仪”可检查司机是否酒后驾车,其反应原理为C2H5OH+4CrO3+6H2SO4═2Cr2(SO4)3+2CO2↑+9X,反应中红色的CrO3转变为绿色的Cr2(SO4)3,其中X的化学式为
H2O
.(2)下图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子:
 由“
由“ ”聚集成的物质
”聚集成的物质可能
(填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数比为1:2(或2:1)
,此反应的基本反应类型为化合反应
.(3)已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),m1
小于
m2.小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因是生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中
.分析:(1)根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所的物质的化学式;
(2)观察微观模拟图,总结构成物质的基本微粒,找出化学反应中各物质的粒子个数关系,通过构成物质的基本微粒判定物质的反应类型;
(3)根据质量守恒定律和实验现象分析.
(2)观察微观模拟图,总结构成物质的基本微粒,找出化学反应中各物质的粒子个数关系,通过构成物质的基本微粒判定物质的反应类型;
(3)根据质量守恒定律和实验现象分析.
解答:解:(1)根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为C,2;H,18;Cr,4;O,37;S,6;已知生成物中含有的原子种类及原子个数为C,2;Cr,4;O,28;S,6;比较分析可知X中含有H和O元素,其原子个数分别为2和1,故X的化学式为H2O;
(2)图示表示 由“ ”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;
”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;
每1个反应物分子和2个另一种反应物分子反应,两种反应物分子个数比为1:2(或2:1);该反应的反应物是两种,生成物是一种,属于化合反应.
(3)根据质量守恒定律,生成氧化镁的质量=参加反应的镁的质量+氧气的质量,所以m1小于m2;镁带燃烧时放出耀眼的白光,放出大量的热,放出大量的白烟,仔细观察会发现:白烟有很大一部分向上,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中.
故答案为:(1)H2O;
(2)可能,1:2(或2:1);化合反应;
(3)小于,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中.
(2)图示表示 由“
 ”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;
”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;每1个反应物分子和2个另一种反应物分子反应,两种反应物分子个数比为1:2(或2:1);该反应的反应物是两种,生成物是一种,属于化合反应.
(3)根据质量守恒定律,生成氧化镁的质量=参加反应的镁的质量+氧气的质量,所以m1小于m2;镁带燃烧时放出耀眼的白光,放出大量的热,放出大量的白烟,仔细观察会发现:白烟有很大一部分向上,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中.
故答案为:(1)H2O;
(2)可能,1:2(或2:1);化合反应;
(3)小于,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中.
点评:此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御.

练习册系列答案
相关题目
 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: 由“
由“ ”聚集成的物质
”聚集成的物质 质量守恒定律的定量研究对化学科学发展具有重大意义.
质量守恒定律的定量研究对化学科学发展具有重大意义. ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: ”聚集成的物质
”聚集成的物质 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: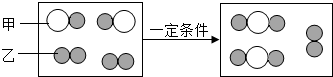
 ”聚集成的物质
”聚集成的物质