��Ŀ����
����Ŀ��ij��ҵ�����к���п��ͭ������ͭ��ijѧ������������̵õ�����п�����ͭ����ش�
�� д�����������в��������ķ�Ӧ�Ļ�ѧ����ʽ______��
�� ���������з�Ӧ��������п�IJ�����____����
�� ��Ҫ�ⶨ������ͭԪ�ص�������������Ҫ�ⶨ�������Dz�����õ���Cu��������______��������M��ҺӦѡ��������Һ�е�______��
A��ϡ���� B��ϡ���� C������ͭ��Һ D������������Һ
���𰸡� Zn+H2SO4��ZnSO4+H2�� 3 ������Ʒ����b B
���������ٸ��ݷ�Ӧ��������Ӧԭ�����
�ڸ��ݷ�Ӧ���̷�����
�۸���ȷ��ij�������������Ĺ�ʽ������𣻸��ݳ�ȥ������п���������µ����ʷ������
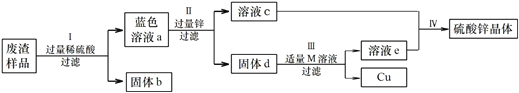
�⣺�ٷ�Ӧ����п��ϡ���ᣬ�������в��������ķ�Ӧ�Ļ�ѧ����ʽZn+H2SO4��ZnSO4+H2����
�ڢ���п��ϡ���ᷴӦ��������п�����й�����п����ɫ����ͭ��Һ��Ӧ��������п�����й���п������M��Һ��Ӧ��������п����3����������п��
��Ҫ�ⶨ������ͭԪ�ص�������������Ҫ֪��Cu�������ͷ�������������Cu����������������õ���Cu���������е�����ͭ��ͭ���������ͷ�����ԭ�е�ͭ��������b�������������������Ʒ����b����ȥ����d�й�����п�õ�����п��Һ���������µ����ʹ�M��ҺӦѡ��ϡ���ᣬ��ѡB��

����Ŀ����7�֣�ij��ѧ��ȤС������ͼװ�����ľ̿��ԭ����ͭ��ʵ�飬�������ɵĺ�ɫ����ɷֽ���̽����

�����������ľ̿������ͭ��Ӧ���ɵĺ�ɫ�����к���ʲô���ʣ�
������������ľ̿������ͭ��ӦҲ��������������ͭ��Cu2O����������ͭ�Ǻ�ɫ���壬����ϡ���ᷴӦ��Cu2O+H2SO4![]() Cu+CuSO4+H2O��
Cu+CuSO4+H2O��
�����в�����ľ̿������ͭ��Ӧ���ɵĺ�ɫ����ɷ֣�
��ȫ����ͭ�� ��ȫ���� �� �������ߵĻ���
��ʵ��̽����
��1������ͼװ�����ľ̿��ԭ����ͭ��ʵ�飬�۲쵽����ʯ��ˮ ��
��2���Թ���ȴ�۲쵽��ɫ����ȫ����Ϊ��ɫ�������ɵĺ�ɫ����ɷֽ���̽����
�� �� | �� �� | �� �� |
��ȡ1.8g��ɫ�������Թ��У� �μ����� ����ַ�Ӧ | ����ٴ��� | |
�ڹ��ˣ�������ϴ�ӡ�������� | ���ù������� | �������ȷ |
����˼��������ľ̿��ԭ����ͭ��ʵ���У����ɵ�������ܺ���һ����̼��Ϊ�˷�ֹ�Կ��������Ⱦ���ɽ���ͼ���߷����ڵ�װ�ø�Ϊ ��ѡ����ĸ����



