题目内容
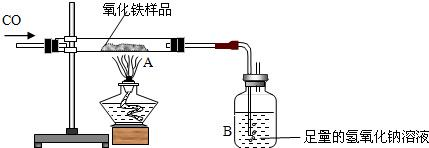
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,并用如图所示的装置进行实验,得到如下两组数据: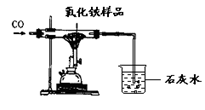
| | 反应前 | 氧化铁完全反应后 |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.8g |
(1)你认为应选择 组的实验数据来计算样品中氧化铁的质量分数,计算结果为 。
(2)这位同学所用的实验装置的不足之处 。
(1)A 80% (2)缺少尾气处理装置
解析试题分析:(1)应该用A组数据计算,不用B组数据,是因为不知氢氧化钙溶液是否足量,即无法确定反应过程中生成的二氧化碳是否被石灰水完全吸收完,也就不知道二氧化碳的质量,所以无法计算。
因为反应前玻璃管和固体样品的质量是43.7g,反应结束后玻璃管和固体样品的质量是41.3g,故固体物质质量减少2.4g;根据反应的原理可知,减少的质量为参加反应的氧化铁中氧元素的质量,据此计算。
设该反应中参加反应的 Fe2O3的质量为x,
3CO+Fe2O3 2Fe+3CO2 固体减少的质量△
2Fe+3CO2 固体减少的质量△
160 112 160-112=48
x 2.4g
160:48=x:2.4g
解得,x=8
所以药品中Fe2O3的质量分数=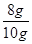 ×100%=80%
×100%=80%
(2)由于CO有毒,不能直接排入空气中,否则会对空气造成污染,故需要尾气处理装置,而该实验没有。
考点:一氧化碳还原氧化铁,实验数据处理或者误差分析的探究,根据化学反应方程式的计算
点评:熟练掌握一氧化碳还原氧化铁的实验原理、操作及注意事项等是解题的关键,关于实验数据的处理,是本题的难点,而解答的关键是二氧化碳是否能被完全吸收。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
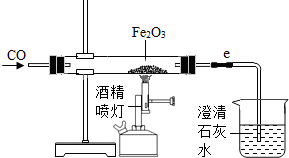 现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用下图所示装置进行实验,得到以下两组实验数据.
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用下图所示装置进行实验,得到以下两组实验数据.| 反应前 | 氧化铁完全反应后 | |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体物质的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.2g |
(2)这位同学所用实验装置的不足之处是
右图为实验室研究炼铁的化学原理的装置,请回答和该实验有关的问题
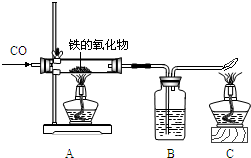
(1)A处玻璃管中发生反应的化学方程式为
(2)B处的实验现象
(3)C处酒精灯的作用
(4)现有含杂质的氧化铁样品10克(杂质不参加反应),为测定该样品中氧化铁的质量分数,某同学用右图所示的装置进行实验,得到如下两组数据:
你认为应选择 组的数据来计算样品中氧化铁的质量分数,其结果为 .

(1)A处玻璃管中发生反应的化学方程式为
(2)B处的实验现象
(3)C处酒精灯的作用
(4)现有含杂质的氧化铁样品10克(杂质不参加反应),为测定该样品中氧化铁的质量分数,某同学用右图所示的装置进行实验,得到如下两组数据:
| 反应前 | 氧化铁完全反应后 | |
| 甲组 | 洗气瓶和石灰水的质量为190g | 洗气瓶和石灰水的质量为196g |
| 乙组 | 玻璃管和氧化铁样品的质量为57.9g | 玻璃管和氧化铁样品的质量为55.2g |
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学取该样品10g.下图为该同学在实验室用一氧化碳还原氧化铁的装置示意图,得到如下两组数据:
(1)在给氧化铁样品加热前,先通一会儿一氧化碳,其目的是
(2)在A处观察到的实验现象是 ,反应的化学方程式为 ;B处观察到的现象是 ,反应的化学方程式为 .
(3)你认为,应当选择 组的实验数据来计算样品氧化铁样品的质量分数,计算的结果为 .
(4)该同学所用实验装置的不足之处是 .

| 反应前 | 氧化铁完全反应后 | |
| a | 玻璃管和氧化铁样品的质量43.7g | 玻璃管内固体物质的质量41.3g |
| b | 集气瓶和氢氧化钠的质量180g | 烧杯和烧杯中物质的质量186.6g |
(2)在A处观察到的实验现象是
(3)你认为,应当选择
(4)该同学所用实验装置的不足之处是
 现有含杂质的氧化铁样品(杂质不参加反应).为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,并用如图所示的装置进行实验,
现有含杂质的氧化铁样品(杂质不参加反应).为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,并用如图所示的装置进行实验,得到如表中两组数据:试回答:
| 反应前 | 氧化铁完全反应后 | |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体物质的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.2g |
(2)这位同学所用实验装置的不足之处是
 (2013?济宁模拟)现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用如图所示装置进行实验,得到以下两组实验数据.
(2013?济宁模拟)现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用如图所示装置进行实验,得到以下两组实验数据.