题目内容
(6分)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表,请你分析并进行有关计算:?
(1)样品中碳酸钠的质量分数是多少?(结果精确到0.1%)?
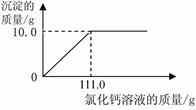
(2)在图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。
实验所得数据见下表,请你分析并进行有关计算:?
| | 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ |
| 加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
| 白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
(2)在图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。

(6分)(1)10.6g?
(2)
(2)

解答这类题目时,首先,要熟记和理解有关含杂质物质的化学反应的有关计算的方法、步骤和格式等相关知识;然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,特别是有关化学方程式的书写和意义、不纯物质的质量与纯物质的质量的相互转化方法,以及根据化学方程式计算的方法、步骤和格式等,细致地阅读、分析题意,联系着生产、生活实际,细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可。
由实验数据可知,11.0g样品中的碳酸钠与氯化钙溶液充分反应最多生成10.0g碳酸钙。
(1)解:设要生成10.0g碳酸钙需要碳酸钠的质量为X?
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl (1分)?
106 100?
X 10.0g (1分)?
106:100 = X:10.0g?
解得X=10.6g (1分)?
样品中碳酸钠的质量分数为: 10.6g/11.0g×100%=96.4% (1分)
由实验数据可知,11.0g样品中的碳酸钠与氯化钙溶液充分反应最多生成10.0g碳酸钙。
(1)解:设要生成10.0g碳酸钙需要碳酸钠的质量为X?
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl (1分)?
106 100?
X 10.0g (1分)?
106:100 = X:10.0g?
解得X=10.6g (1分)?
样品中碳酸钠的质量分数为: 10.6g/11.0g×100%=96.4% (1分)

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 12 CO2↑+ 10 H2O↑+ 6 X↑+ O2↑
12 CO2↑+ 10 H2O↑+ 6 X↑+ O2↑