题目内容
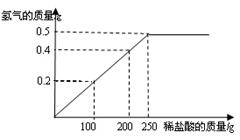
(6分)现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g溶质质量分数为7.3%的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如下图所示.请计算:
(1)原混合物样品中镁的质量分数是 .
(2)要将剩余的稀盐酸完全反应掉,还需加入该样品的质量是多少?(简要写出计算过程)

(1)原混合物样品中镁的质量分数是 .
(2)要将剩余的稀盐酸完全反应掉,还需加入该样品的质量是多少?(简要写出计算过程)
60% 4g
解:设混合物中镁的质量为a,由图知与单质
镁的反应的稀盐酸质量为250g, 生成氢气的质量为
0.5g.
Mg + 2HCl= MgCl2+ H2↑
24 2
a 0.5g
24/2=a/0.5g a=6g
(1)则混合物中镁的质量分数为6g/10g×100%=60%.
(2)由图知,剩余盐酸的质量为350g-250g=100g,其溶质的质量为:100g×7.3%=7.3g,设需要样品的质量为b,则:
Mg + 2HCl= MgCl2+ H2↑
24 73
60%b 7.3g
24/73=60%b/7.3g 解得b=4g.
镁的反应的稀盐酸质量为250g, 生成氢气的质量为
0.5g.
Mg + 2HCl= MgCl2+ H2↑
24 2
a 0.5g
24/2=a/0.5g a=6g
(1)则混合物中镁的质量分数为6g/10g×100%=60%.
(2)由图知,剩余盐酸的质量为350g-250g=100g,其溶质的质量为:100g×7.3%=7.3g,设需要样品的质量为b,则:
Mg + 2HCl= MgCl2+ H2↑
24 73
60%b 7.3g
24/73=60%b/7.3g 解得b=4g.

练习册系列答案
相关题目


