题目内容
【题目】在研究酸和碱的化学性质时,某小组同学想证明稀盐酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验,并得出有关结论。
(1)探究稀盐酸和氢氧化钠溶液的反应:
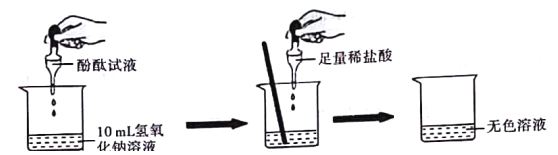
当滴入几滴酚酞试液后,溶液由无色变为__________色。根据上述实验中颜色变化,可确定稀盐酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为____________________。
(2)探究上述稀盐酸和氢氧化钠溶液反应后烧杯中的盐酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量。同学们又分别选取硝酸银溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的硝酸银溶液 | 出现白色沉淀 | 稀盐酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
在述设计的实验方案中,正确的是__________(填“方案一”或“方案二”),另外一个实验方案错误的原因是______________________________。
(3)若请你再设计一个确定稀盐酸是否过量的实验方案,你选用的药品是__________,实验现象及结论是______________________________。
【答案】 红 NaOH + HCl == NaCl + H2O 方案二 氢氧化钠与稀盐酸反应后生成的氯化钠也能与硝酸银溶液反应生成白色沉淀氯化银 锌粒 有气泡冒出,则稀盐酸过量,反之,稀盐酸不过量
【解析】(1)氢氧化钠溶液显碱性,酚酞溶液遇碱性溶液变红。NaOH + HCl == NaCl + H2O (2)方案二是正确的,因为方案一中,氢氧化钠与稀盐酸反应后生成的氯化钠也能与硝酸银溶液反应生成白色沉淀氯化银。(3)锌粒。锌能与稀盐酸反应生成氢气,有气泡冒出,则稀盐酸过量,反之,稀盐酸不过量。

【题目】碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
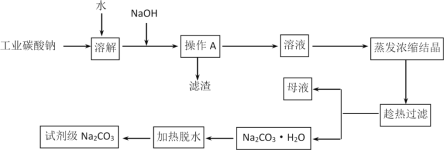
碳酸钠的饱和溶液在不同温度下析出的溶质如下表所示:
温度(℃) | ﹤32 | 32~36 | ﹥36 |
析出物的化学式 | Na2CO3·10H2O | Na2CO3·7H2O | Na2CO3·H2O |
回答下列问题:
(1)操作A为过滤,所需的玻璃仪器有烧杯、玻璃棒和_____________,滤渣的主要成分为Fe(OH)3、Mg(OH)2和___________。
(2)“趁热过滤”的原因是____________________。
(3)“母液”中除了含有 Na+、CO32-、Cl-、OH-离子外,还含有________等离子(写出一个即可)。
(4)写出Na2CO3·H2O转化为Na2CO3的化学方程式_______________________________________。