题目内容
【题目】下图是对生成氯化钠反应关系的归纳与整理。
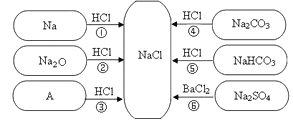
(1)物质A 是常见的碱,写出A 的化学式:_____________。
(2)反应④的类型为:____________ 。
(3)说出NaHCO3在医疗上的一种用途:___________________________ 。
(4)反应③、④、⑤、⑥能够进行的原因是___________________________ 。
(5)实验室配制200g 8 %的NaCl 溶液,需要水的质量是________g ,配制过程中为了加快NaCl 的溶解,可以采取的措施是___________________________ 。
【答案】 NaOH 复分解 治疗胃酸过多 有气体或沉淀或水生成 184g 用玻璃棒搅拌
【解析】(1)碱是指电离出的阴离子全部是氢氧根离子的化合物,A中含有钠元素又属于常见的碱,所以是氢氧化钠;
(2)反应④是碳酸钠与盐酸反应,相互交换成分,生成氯化钠和水和二氧化碳,故该反应为复分解反应;
(3)碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,胃酸主要成分是盐酸,所以NaHCO3在医疗上的一种用途是可以治疗胃酸过多;
(4)反应③是碱与酸发生复分解反应有水生成、反应④⑤是盐与酸发生复分解反应有水和气体生成、反应⑥是盐与盐发生复分解反应有沉淀生成,复分解反应的条件是生成物中有沉淀、气体或水,反应③、④、⑤、⑥能够进行的原因是:有水或沉淀或气体产生;
(5)溶质质量=溶液质量×溶质的质量分数,配制200g 8%的NaCl溶液,需氯化钠的质量=200g×8%=16g;溶剂质量=溶液质量-溶质质量,则所需水的质量=200g-16g=184g,配制过程中为了加快NaCl的溶解,可用玻璃棒进行搅拌。

【题目】石灰石是生产玻璃、氯化钙等多种化工产品的原料。某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 | 1 | 2 | 3 | 4 |
加入样品质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)第几次反应中矿石有剩余?_________;
(2)表中m值是________;
(3)试计算这种石灰石中碳酸钙的质量分数为_________。