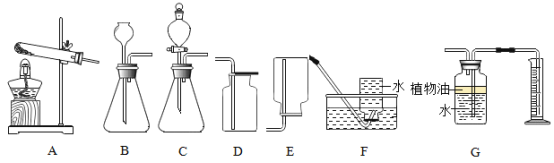
题目内容
【题目】完成下列反应的化学方程式,并回答有关问题。
(1)实验室制取氢气_____;反应后溶液质量跟反应前比_____(填 “增加”“减少”或“不变”);
(2)碳酸氢铵受热分解_____;
(3)乙炔(C2H2)在空气中燃烧生成二氧化碳和水_____。
【答案】Zn+H2SO4=ZnSO4+H2↑ 增加 ![]()
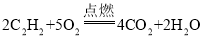
【解析】
(1)实验室常用锌和稀硫酸反应制取氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;因为反应中锌和稀硫酸反应生成硫酸锌和氢气,溶液中的溶质由硫酸变成硫酸锌,质量增加,而溶剂水的质量不变,所以反应后溶液质量跟反应前比增加;
(2)碳酸氢铵受热分解生成氨气、水和二氧化碳,化学方程式为:![]() ;
;
(3)C2H2在空气中燃烧生成二氧化碳和水,化学方程式为: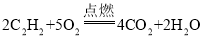 。
。

 阅读快车系列答案
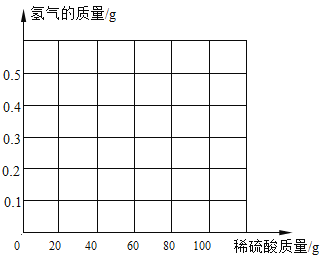
阅读快车系列答案【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,将100g稀硫酸分5次加入其中,使之充分反应.每次所用稀硫酸的质量及剩余物的总质量记录于右表:
加入稀硫酸的质量(g) | 充分反应后剩余物的总质量(g) | |
第1次 | 20 | 39.9 |
第2次 | 20 | 59.8 |
第3次 | 20 | 79.7 |
第4次 | 20 | 99.6 |
第5次 | 20 | 119.6 |
试回答下列问题:
(1)反应结束时产生氢气的质量为______________。
(2)黄铜样品中锌的质量分数是多少? (请写出计算过程)______
(3)请在下图画出氢气的产生曲线。______
【题目】工业炼铁
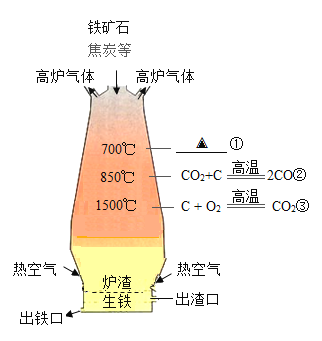
(1)焦炭(主要成分是碳)是高炉炼铁的重要原料。高炉内主要化学反应如图。反应①的化学方程式为_____,反应②体现了焦炭的_____性,该反应_____热(填“放”或“吸”)。
(2)为测定产物生铁中单质铁的质量分数,先后进行了四次实验,实验数据记录如下表(假设每次反应充分)。
第一次 | 第二次 | 第三次 | 第四次 | |
所取生铁的质量/g | 10 | 10 | 10 | 10 |
所加稀硫酸的质量/g | 25 | 50 | 75 | 100 |
生成氢气的质量/g | 0.10 | 0.20 | 0.30 | 0.35 |
根据实验数据,试分析并计算:
①生铁中单质铁的质量分数为多少? (写出计算过程,下同)_____。
②所用稀硫酸的溶质质量分数为多少?_____。
【题目】化学兴趣小组的同学欲测定实验室中某黄铜(铜和锌的合金)样品中铜的质量分数(不考虑黄铜中的其他杂质),他们称量了20g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量如下表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:此黄铜样品中铜的质量分数是少?(写出计算过程)