题目内容
根据质量守恒定律,6 g镁和8 g氧气充分反应,可生成14 g氧化镁。这种说法正确吗?为什么?如不正确,请加以改正
【答案】
略
【解析】解:2Mg+O2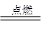 2MgO
2MgO
2×2432
68
由于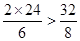 ,所以氧气过量。
,所以氧气过量。
设6 g镁能与氧气反应的质量为x。
2Mg+O2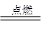 2MgO
2MgO
48 32
6 g x
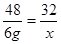 ,x=4 g
,x=4 g
生成氧化镁的质量:6 g + 4 g=10 g。
所以上述说法可以这样改正:
根据质量守恒定律,6 g镁和4 g氧气恰好完全反应后,可以生成10 g氧化镁

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 g氧气充分反应,可生成14 g氧化镁。这种说法正确吗?为什么?如不正确,请利用化学方程式的简单计算以及必要的文字说明加以改正。
g氧气充分反应,可生成14 g氧化镁。这种说法正确吗?为什么?如不正确,请利用化学方程式的简单计算以及必要的文字说明加以改正。