题目内容
【题目】金属钴(Co)在国防工业中有重要应用。某矿石中含钻的氧化物(CoO、Co2O3)研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。
(1)写出下列化合物中Co元素的化合价:CoO_________,Co2O3______________。
(2)酸浸时钴的氧化物发生如下反应:
反应I CoO+H2SO4===CoSO4+H2O
反应Ⅱ 2Co2O3+4H2SO4===4CoSO4+O2↑+4H2O
反应Ⅲ Co2O3+2H2SO4+Na2SO3===2CoSO4+2H2O+Na2SO4
①反应后溶液中含钴元素的微粒是_________ (填化学符号)
②已知反应前矿石中CoO的质量为ag,Co2O3的质量为bg,则理论上可以生成CoSO4____g(用含a、b的式子表示)
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
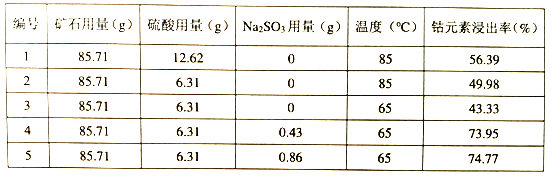
①本实验研究了哪些因素对钴元素浸出率的影响__________________________________;
②根据上表数据,其他条件不变,温度升高,钴元素的浸出率___________________________;
③工业生产中采用实验______________(填编号)的提取条件更合理。
【答案】+2+3Co2+155×(a/75 + b/83)硫酸用量、亚硫酸钠用量、温度增大5
【解析】
(1)单质中元素的化合价为零,化合物中元素的化合价代数和为零。化合物中氧元素的化合价为-2价, CoO中Co为+2价,Co2O3中Co为+3价;(2) ①由上述方程式可知,反应后钴元素以CoSO4存在于溶液中,所以溶液中含钴元素的微粒是Co2+;②设CoO生成CoSO4的质量为x,Co2O3生成CoSO4的质量为y,
CoO+H2SO4===CoSO4+H2O
75 155
ag x 75/ag=166/x x=155×ag÷75
2Co2O3+4H2SO 4===4CoSO4+O2↑+4H2O
332 155×4
bg y 332/bg= 155×4/y y= 155×4×bg÷332
则理论上可以生成CoSO4的质量为:155×(a/75 + b/83);
(3) ①由表格中数据可知,对钴元素浸出率产生影响的因素有硫酸用量、亚硫酸钠用量、温度;②根据上表数据,其他条件不变,温度升高,钴元素的浸出率增大;③工业生产中应采用实验5的方案,因为该条件下,钴元素浸出率最高。