��Ŀ����
��ɫ��������п���׳�𩷯����ҽ������������������ҵ�����������������ɫ���ϣ�п���ף��ȡ�ʵ����ͨ���ô�п�������������ʣ���ϡ���ᷴӦ��ȡ������Ϊ�˳�����������Һ��ijʵ��С���������ҺΪԭ���Ʊ�����п���岢̽�������ʡ�
���Ʊ�����п���壩
��֪���ٿ�ʼ�����������������������ȫ��pHֵ�ķ�Χ�ֱ�Ϊ��Fe(OH)3��2.7��3.7 Fe(OH)2��7.6��9.6 Zn(OH)2��5.7��8
������п���ھƾ�
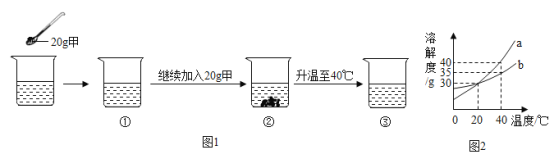
ʵ��������ͼ��ʾ��

�Իش��������⣺
��1��ʵ������ȡ������ԭ��_______ (�û�ѧ����ʽ��ʾ)��
��2����ҺA�м����Լ��ٵ�Ŀ����ʹFeSO4ת��ΪFe2(SO4)3��ͨ���ù���������Һ���÷�Ӧ�Ļ�ѧ����ʽΪ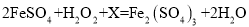 ��X�Ļ�ѧʽΪ____________��
��X�Ļ�ѧʽΪ____________��
��3�����Լ��ڵ�Ŀ����ʹ��Ԫ����ȫ�����������Լ������ѡ��_________��
A ZnO
B Zn(OH)2
C NaOH
D ZnSO4
��4���ᾧ�����Ĺ��̰���������Ũ����_________��
��5�����һ�ι��˵õ��ľ����þƾ�ϴ�Ӿ��������ˮϴ��Ŀ����_____��
���ⶨ����п����ZnSO4��xH2O�нᾧˮ�ĺ�����
ʵ��С��ͬѧ�����յ���𩷯���壨ZnSO4��xH2O���������װ�òⶨ�����нᾧˮ�ĺ�����ͼ�а�Ĥ��������ͨ���ֿɷ�ֹ�����ĩ���뵼�ܣ����ⶨ��������ȡ28.7g��������Cװ�õ�Ӳ�ʲ������У���������ȫʧȥ�ᾧˮ���� ������ȴ�����º����������й��壬������Ϊ16.1g��
������ȴ�����º����������й��壬������Ϊ16.1g��

��1��A�еĻ�ѧ����ʽ��_____��B�е��Լ��ɴ�����������ѡȡ�����ѡ����_____��
A Ũ����
B ��������Һ
C ����̼������Һ
D ����ʯ��ˮ
��2��ʵ�����������ͨ�������õĽ����_______���ƫ��ƫС������Ӱ�족��������ʵ����������𩷯�����нᾧˮ��xֵΪ____________����д��������̣�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�


 ����̿������ζ��
����̿������ζ�� Һ�����ڻ������
Һ�����ڻ������ ʯī�����缫
ʯī�����缫 �ɱ�����ʳƷ����
�ɱ�����ʳƷ����