题目内容
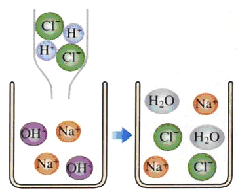
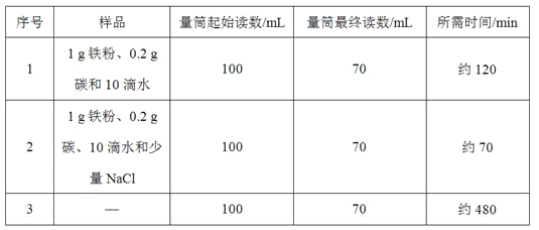
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
(1)固体A与某酸反应的化学方程式为____________。操作②时,当__________即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为__________。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是_____________(填化学式)。
【答案】 Mg(OH)2+H2SO4=MgSO4+2H2O 少量水(或析出大量晶体) H2O NaCl、Na2SO4
【解析】本题考查了酸、碱、盐的化学性质,混合物的分离等。根据物质的性质以及物质间的反应,结合化学方程式的书写的知识进行分析解答。
工业废水加入氢氧化钠溶液,会与硫酸镁反应生成氢氧化镁沉淀和硫酸钠,与氯化铁反应生成氢氧化铁沉淀和氯化钠,A中加入某酸后得到硫酸镁,则加入的酸是硫酸,固体A是氢氧化镁;固体B加热得到的是氧化铁, 则B是氢氧化铁,溶液a中含有生成的氯化钠和硫酸钠。因此:
(1)固体A与某酸反应是氢氧化镁与硫酸的反应,生成的是硫酸镁和水,反应的化学方程式为Mg(OH)2+H2SO4=MgSO4+2H2O;操作②是蒸发操作,当还有少量水(或析出大量晶体)时停止加热;
(2)固体B是氢氧化铁,加热的产物是两种常见氧化物,一种是氧化铁,根据质量守恒定律可知,另一种氧化物是水,化学式是H2O;
(3)溶液a中含有生成的氯化钠和硫酸钠,化学式分别是NaCl、Na2SO4。

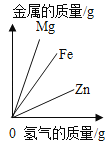
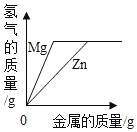
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D