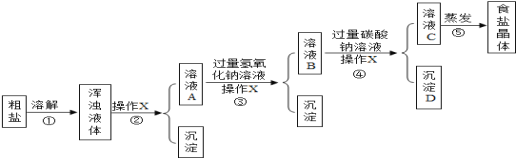
��Ŀ����
����Ŀ�����Ա����顱�ǻ�ѧѧϰ����֮��Ч��˼ά������ij��ѧѧϰС���ͬѧ��ѧ����صĻ�ѧ֪ʶ���߽�ʵ���������������飬������벢�ش����⣮
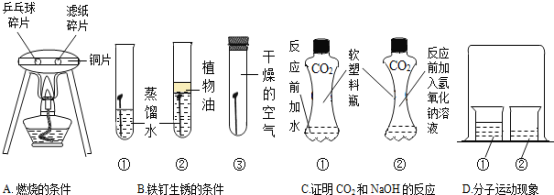
��1��ͨ������A������˵��ȼ�յ�����֮һ�� ��ʵ����ʹ��ͭƬ����������ͭ�� �ԣ���һ���������ʣ���
��2������ʵ��B��һ��ʱ��۲��Թܢ��е�����������ʴ���ɴ˵ó������������Ҫ��������������ˮ�� ֱ�ӽӴ�������ȥ������ü� ��ϴ�ķ���������Ʒ����ʱ ����ܡ����ܡ�����ʱ���������Һ�У�
��3��ʵ��C�����������ͬ������CO2��������ƿ��������ˮ��ƿ�٣���NaOH��Һ��ƿ�ڣ�����ʵ�飬��������ƿ���ij̶�֤��CO2��NaOH��Һ�е�����ȷʵ�����˷�Ӧ����һ��Ӧ�Ļ�ѧ����ʽΪ
��4��ʵ��D���ձ����г��ֵ�������˵�������Dz����˶��ģ����ձ�����Һ��ʱŨ��ˮʱ���ձ����еķ�̪��Һ����ɫ��Ϊ ɫ�����ձ�����Һ�廻��Ũ���ᣬ���ձ�����Һ�廻�ɵ��з�̪NaOH��Һʱ��һ��ʱ�����Һ��ɫ�ı仯�� ��
���𰸡���1���¶ȴﵽ��ȼ����Ż�㣬���ȣ���2�������������ϡ���ᣬ���ܣ�
��3��2NaOH+CO2�TNa2CO3+H2O��4����ɫ����ɫ����ȥ��Ϊ��ɫ��
![]() ��������
��������
�����������1��ȼ�յ����������ʾ��п�ȼ�ԡ��������Ӵ����¶ȴﵽ��ȼ����Ż�㡣ʵ��A��ƹ������Ƭ����ֽ��Ƭ���������Ӵ������ڼ��ȵĹ����У�����ͭƬ�ĵ����ԣ���ͼ��֪�����߶��ܹ��������ȣ�����ƹ������Ƭ���Ż��ͣ���ȼ��������˵��ȼ����Ҫ�¶ȴﵽ��ȼ����Ż�����ʴ�Ϊ�� �¶ȴﵽ��ȼ����Ż�㣻���ȡ���2���Ա��Թ��٢�����֪�����������֮һ������ˮֱ�ӽӴ����Ա��Թ��٢�����֪�����������һ�������������������������ֱ�ӽӴ����ɴ˵ó������������Ҫ����������ˮ�Ϳ�������������ֱ�ӽӴ������������ᷴӦ���ʳ�ȥ��������������ϡ���ᡣ��Ҳ�����ᷢ����Ӧ��������Ʒ����ʱ���ܳ�ʱ��������С��ʴ�Ϊ�����������������������ϡ��������������3��NaOH����CO2��Ӧ����Na2CO3�� H2O����Ӧ����ʽΪ��2NaOH+CO2�TNa2CO3+H2O����4��Ũ��ˮ�ӷ����ʼ��ԣ��ӷ����İ��������̪��Һ�У���ʹ��̪��죻Ũ�����ӷ����ӷ�����HCl���ӽ�����з�̪��NaOH��Һ�У�HCl��NaOH��Ӧ����NaCl��H2O��NaCl�����ԣ�����ʹ��̪��ɫ������Һ�еĺ�ɫ����ȥ���ʴ�Ϊ����ɫ����ɫ����ȥ��Ϊ��ɫ��

����Ŀ�����в�����ȷ����
A�� | ����ʣ��ҩƷ����ָ���������� | |
B�� | ʵ����Ũ�����մ�����ϣ�������ˮ��ϴ | |
C�� | ����˿��������ȼ�յ�ʵ��ʱ�����ռ������ļ���ƿ��������ˮ | |
D�� | ����ʱ��������Һ�嵹��������� |
����Ŀ���о�ѧϰС��ѡ��������̿������Ч������Щ�����й����Ŀ�������о�������������̽���Ĺ��̣�
������裺����̿������Ч���ͻ���̿�����й�
���ʵ�飺���±�����ʵ�飬ȡ�ݻ���ͬ�ļ���ƿ��125ml�����ռ�������ɫ�Ķ����������壬�����б�ţ���¼��ɫ��ʧ��ʱ�䡣
ʵ���� | ����̿���� | ����̿���������ˣ� | ��ʧʱ�䣨�룩 |
1 | 80% | 1.0 | 60 |
2 | 9.0 | 45 |
�������ݣ��ó�����
Ҫ��ɱ�ʵ�飬ʵ����2�л���̿�Ĵ���Ӧ��Ϊ
��1����̽�����̵ó��Ľ����ǣ�
��˼��
ijƷ�Ʊ���ij�ζ����Ҫ�ɷ��ǻ���̿����˵������д����������������ԭ���ǻ���̿��
�У� д���ܷ�ӳ�����ʵĻ�ѧ����ʽ��
��3������̿������Ч��������Щ�����йأ���������Ǽ���̽����ֻҪ����������ʵ�鷽������
���裺
ʵ�鷽����
��4���������û���̿�������Ի�����