题目内容
【题目】核电荷数为1~18的元素的原子结构示意图等信息如图,回答下列问题:
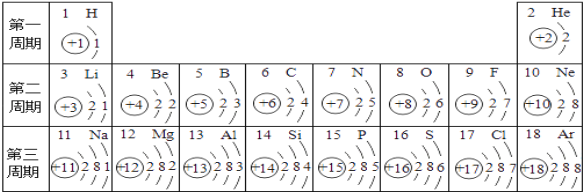
⑴硅原子的核电荷数为_______________。
⑵16号元素的原子在化学反应中比较容易_______(填“得”或“失”)电子;该元素属于_____(填“金属”或“非金属”)元素。
⑶表中与10号元素的化学性质相似的元素的元素符号有___________________。
⑷在第三周期中,各原子结构的共同之处是___________;该周期中各元素的本质区别是________。
⑸写出核外电子排布与氖原子相同的一个阳离子符号____________。
⑹12号元素与17号元素组成的化合物的化学式为___________,构成该物质的微粒是__________
(选填“分子”“原子”或“离子”)。
【答案】14得非金属He Ar电子层数相同核电荷数或质子数不同Na+或Mg2+或Al3+MgCl2离子
【解析】
(1)硅是14号元素,硅原子的核电荷数为14;
(2)根据16号元素原子结构示意图可知,最外层电子数是6,在化学反应中其原子比较容易得到2个电子变成离子;16号元素是硫,属于非金属元素;
(3)10号元素是氖元素,氖原子最外层8个电子,在化学变化中比较稳定,表中与其化学性质相似的元素是氦、氩,符号为:He、Ar;
(4)在第三周期中,各原子结构的共同之处是原子核外电子层数相同;决定元素种类的是质子数或核电荷数,该周期中各元素的本质区别是核电荷数或质子数不同;
(5)核外电子排布与与氖原子相同的阳离子可能是钠离子或镁离子以及铝离子,符号为:Na+或Mg2+或Al3+;
(6)12号元素与17号元素分别是镁元素和氯元素,镁元素和氯元素分别显+2价、-1价,其化合物的化学式为:MgCl2,构成该物质的微粒是离子。

【题目】实验室有一包白色粉末A,经分析由Na2CO3、NaHCO3、CaCO3中的一种、两种或三种组成。小明为确定其成分进行了如下探究:
(提出假设)白色粉末A的成分可能是
假设1:Na2CO3和NaHCO3;
假设2:CaCO3和Na2CO3;
假设3:CaCO3、Na2CO3和NaHCO3
白色粉末的组成还有___________种可能。
(查阅资料)小明收集了以下一些可能用到的相关资料
(资料1)向碳酸钠溶液中滴加酚酞试液溶液显红色,向碳酸氢钠溶液中滴加酚酞试液溶液显粉红色。
(资料2)碳酸氢钠能与碱溶液反应。如NaOH+NaHCO3=Na2CO3+H2O
(资料3)部分酸、碱、盐的溶解性表(20℃)
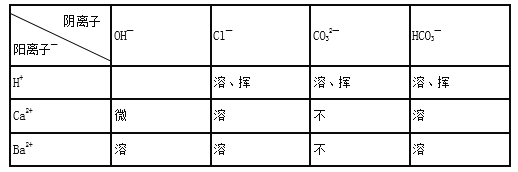
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性
(实验设计)小明依据查阅的有关资料设计了如下实验方案,请完成下面的表格.
实验步骤 | 实验操作 | 实验现象 | 实验结论 |
一 | 向A的试样中加入足量的水 | ①A的试样全部溶解 | A不可能含CaCO3 |
②A的试样部分溶解 | A是CaCO3和Na2CO3 或 ____________ 或CaCO3、Na2CO3和NaHCO3 | ||
③A的试样全都不溶 | A是CaCO3 | ||
二 | 若A的试样部分溶解则向其滤液中先加入过量试剂X________(填X的化学式),再加入无色酚酞 | ④溶液变粉红色 | A是NaHCO3和CaCO3 |
⑤产生白色沉淀,溶液不变色 | A是CaCO3和Na2CO3 | ||
⑥ _________________ | A是CaCO3、Na2CO3和NaHCO3 |
(实验结论)小明通过实施上述实验方案最终确定了A的成分。
(评价反思)实验结束后,小明对整个实验设计和过程进行了反思,你认为下列反思正确的是__________________。
A.在“实验步骤二”中也可以用Ca(OH)2来代替X确定A的成分
B.该实验方案不够完整,若A试样全都溶解时,并未设计方案进行进一步确定A的成分
C.为节约药品,在“实验步骤二”中X可以取少量,不会影响实验结论
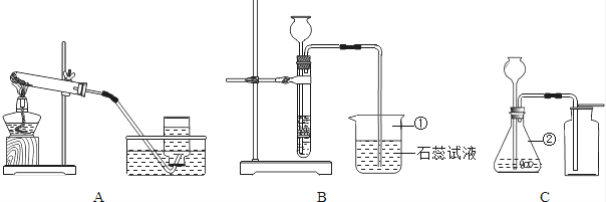
【题目】某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰.该小组同学进行如下探究:

(1)探究一:铁丝在氧气中燃烧为什么会火星四射?
下表是小组同学将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录:
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时的现象 | 剧烈燃烧,发出耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | 未填 |
请你分析并回答:写出铁丝在氧气中燃烧的化学表达式:_____,铁燃烧时的“火星四射”现象可能与_____有关,表中未填的一项你估计应当是________。
(2)探究二:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入火焰,导出其中物质,在另一端管口点燃,也有火焰产生.由此可知:蜡烛燃烧产生的火焰是由________(填“固态”或“气态”)物质燃烧构成的。
(3)探究三:物质燃烧产生火焰的根本原因是什么?
查阅资料
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50~70 | 300~550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由表中数据可知:物质燃烧能否产生火焰与其________(填“熔点”或“沸点”)和燃烧时温度有关,由此推测:钠在燃烧时,________(填“有”或“没有”)火焰产生。