题目内容
相同质量的KClO3、H2O2和H2O,完全分解产生氧气的质量( )A.KClO3最多
B.H2O2最多
C.H2O最多
D.一样多
【答案】分析:首先比较KClO3和H2O,因为它们化学式中的氧元素全部转化为氧气.根据相同质量的氧元素,物质质量越少的,在物质质量相同的情况下,则生成的氧气越多进行比较,然后选出放出氧气质量最多的再与双氧水比较,双氧水中有一半的氧元素转化为氧气.
解答:解:KClO3和H2O中的氧元素全部转化为氧气,可通过比较相同质量的氧元素,物质质量越少的,在物质质量相同的情况下,则生成的氧气越多,故化学式可改为:KClO3和H6O3,很显然,是水分解产生的氧气多.
再比较水和双氧水,双氧水中有一半的氧元素转化为氧气,故H2O2和H2O分子个数一样多时,放出的氧气质量相等,由分子可以看出,当质量相等时,水放出的氧气质量最多.
故选C
点评:解答本题可利用质量守恒定律元素守恒进行相关分析计算,只有这样才能对问题做出正确的判断.
解答:解:KClO3和H2O中的氧元素全部转化为氧气,可通过比较相同质量的氧元素,物质质量越少的,在物质质量相同的情况下,则生成的氧气越多,故化学式可改为:KClO3和H6O3,很显然,是水分解产生的氧气多.
再比较水和双氧水,双氧水中有一半的氧元素转化为氧气,故H2O2和H2O分子个数一样多时,放出的氧气质量相等,由分子可以看出,当质量相等时,水放出的氧气质量最多.
故选C
点评:解答本题可利用质量守恒定律元素守恒进行相关分析计算,只有这样才能对问题做出正确的判断.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
下列四个图象表示四种对应的操作过程,其中正确的是( )
A、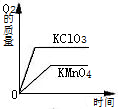 分别加热相同质量的KClO3和KMnO4 | B、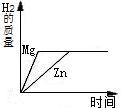 相同质量的镁、锌跟足量的稀硫酸制取氢气 | C、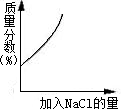 某温度下,在不饱和的食盐水中逐渐加入食盐晶体 | D、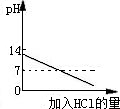 将盐酸滴入氢氧化钠溶液中,直至盐酸过量 |